Лечение ИМПА значительно отличается от лечения многих других состояний, которые могут проявляться сходными клиническими признаками, и протоколы могут различаться у разных пациентов. Поэтому постановка точного диагноза имеет решающее значение. В этой статье определены некоторые из ключевых соображений для установления диагноза и составления соответствующих планов лечения собак с ИМПА.
Клиническая картина
Одной из проблем в распознавании ИМПА является разнообразие возможных клинических проявлений. Наиболее очевидные клинические признаки включают нежелание ходить, изменение походки или хромоту, множественные опухшие и болезненные суставы [1,5]. Собаки часто имеют ходульную походку или кажутся «ходящими на яичной скорлупе», а хромота может присутствовать на разных конечностях в разное время. Также может присутствовать боль в позвоночнике из-за воспаления фасеточных суставов или сопутствующего менингита[3].
Другие клинические признаки, связанные с ИМПА (например, лихорадка, вялость, отсутствие аппетита, рвота или диарея), могут быть менее полезными для локализации проблемы в суставах. Эти признаки иногда являются единственными, наблюдаемыми у пациентов с ИМПА [4, 6]. Например, в исследованиях собак, представленных для дальнейшего исследования в связи с лихорадкой неизвестного происхождения, от 8% до 40% был диагностирован ИМПА, и у многих не было явных болей в суставах или припухлости. 6-8 В другом исследовании собак с ИМПА у большинства из них отмечалась скованность или трудности при ходьбе (80%), но только у 40% была обнаружена боль в суставах [4]. Хотя некоторые породы чрезмерно представлены в исследованиях, ИМПА может поражать собак любой породы, пола, возраста или размера [3,6]. Поэтому важно рассматривать ИМПА в качестве первичной дифференциальной диагностики не только в случаях с явным заболеванием суставов, но и в случаях с общим снижением подвижности или хронической лихорадкой.
Определения
ИМПА обычно определяется синовиальным накоплением иммунных комплексов (гиперчувствительность III типа), которое запускает каскадную реакцию, привлекающую нейтрофилы в сустав [9]. Некоторые эрозивные формы ИМПА могут также включать опосредованный Т-клетками ответ (гиперчувствительность типа IV), направленный против суставного хряща.
Исторически сложилось так, что ИМПА у собак часто подразделяют на 4 типа: идиопатический (тип I), вторичный по отношению к инфекции, не связанной с суставами (тип II), вторичный по отношению к желудочно-кишечному заболеванию (тип III) и вторичный по отношению к неоплазии (тип IV) [1].Более упрощенный подход заключается в разделении ИМПА на первичное и вторичное заболевание. Первичный ИМПА описывает идиопатические случаи, вторичный или реактивный ИМПА описывает любую ситуацию, в которой образование иммунных комплексов может быть связано с выявленной основной проблемой вне суставов. Независимо от используемой системы классификации, различение типа ИМПА может помочь клиницистам тщательно рассмотреть возможные основные причинные состояния и разработать соответствующие диагностические планы.
Диагноз
Когда у собаки наблюдается ненормальная походка или хромота, первые шаги включают попытку определить, связана ли основная проблема с мышцами, нервной системой, другими мягкими тканями, длинными костями или суставами. Даже когда суставы явно болезненны, следует рассмотреть другие дифференциальные диагнозы. Некоторые из наиболее частых причин полиартропатии перечислены во ВСТАВКЕ 1. Характеристики подмножества полиартропатий ИМПА включают воспаление суставов, отсутствие инфекции или новообразований, непосредственно поражающих суставы, и положительный ответ на иммуносупрессивную терапию.
ВСТАВКА 1. Дифференциальный диагноз полиартропатий собак.

В то время как клинический диагноз ИМПА обычно устанавливается с помощью артроцентеза с анализом синовиальной жидкости для выявления нейтрофильной реакции, общий диагностический подход должен также гарантировать, что (1) учитываются соответствующие альтернативные диагнозы, такие как невоспалительный или септический артрит, и (2) пациент должным образом оценены для возможных основных причин вторичного ИМПА.
РИСУНОК 1 представляет собой обобщенный общий диагностический подход при подозрении на ИМПА. План для любого отдельного пациента может значительно отличаться от этого подхода в зависимости от клинической картины.
РИСУНОК 1 Общий диагностический подход при подозрении на ИМПА.
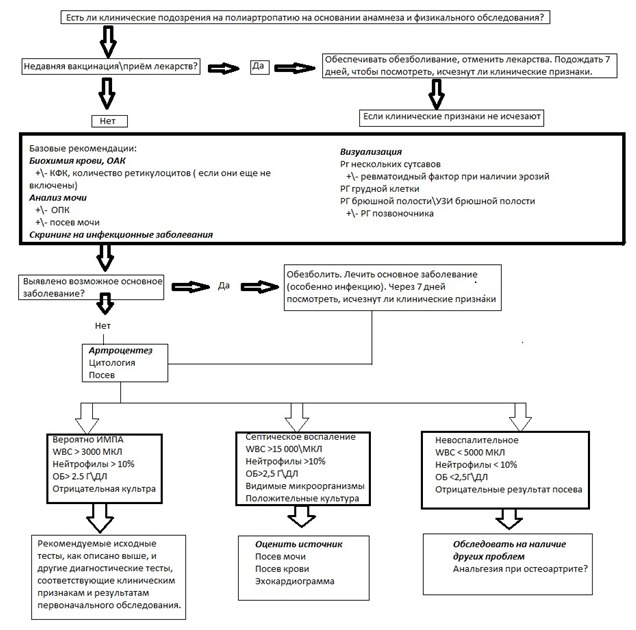
РИСУНОК 1. Общий диагностический алгоритм для случаев подозрения на полиартропатию
* Всегда уместно учитывать исходные тесты и артроцертесс, чтобы помочь установить диагноз
КФК = креатинфосфокинеза; ОБ- общий белок, ОПК = отношение профезина к креатинину в моче, WBC = количество лейкоцитов.
Тщательный сбор анамнеза и физикальное обследование важны во всех случаях. Особые соображения, связанные с анамнезом, включают полную категоризацию клинических признаков, примечание о географически значимых потенциальных контактах с инфекционными заболеваниями, недавно введенных лекарствах или вакцинах, а также о том, получал ли пациент профилактические средства от блох и клещей. Физикальное обследование может быть чрезвычайно полезным для локализации источника проблем у животных с хромотой или ненормальной походкой. Это также имеет решающее значение для выявления подсказок о потенциальных основных заболеваниях, которые могут вызвать вторичный ИМПА, и может помочь в проведении дополнительного тестирования.
Артроцентез может быть выполнен в начале исследования или после исходных тестов, как показано на РИСУНКЕ 1. Седация или анестезия обычно используются, чтобы избежать дискомфорта пациента и облегчить иммобилизацию суставов, что может помочь предотвратить заражение крови. Несколько источников предоставляют прекрасную информацию о методах аспирации жидкости из различных суставов [10,11]. Некоторые советы по получению наиболее полезной информации из анализа суставной жидкости приведены во ВСТАВКЕ 2 . Одним из ключевых моментов является сбор жидкости из нескольких суставов, поскольку не все они могут быть поражены в одинаковой степени.
ВСТАВКА 2 Получение максимальной отдачи от артроцентеза.
Нормальная синовиальная жидкость должна содержать <3000 лейкоцитов на микролитр с преобладанием мононуклеарных клеток и <2,5 г/дл белка [15]. В большинстве случаев ИМПА наблюдается значительно более высокое количество лейкоцитов с преобладанием нейтрофилов и более высокой концентрацией белка. Типичные характеристики количества клеток, клеточной популяции и концентрации белка в суставной жидкости для нескольких состояний включены в ТАБЛИЦУ 1 . Однако может быть трудно охарактеризовать конкретный болезненный процесс только с помощью этих параметров, потому что между различными заболеваниями может быть значительное совпадение и есть исключения из каждого ожидания.
Также обычно рекомендуется культивировать образец как минимум из 1 сустава. Лучшими образцами для посева являются наиболее сильно аномальные, например, те, которые обесцвечены или имеют заметно сниженную вязкость, или образцы с наибольшим количеством полученной жидкости. К сожалению, некоторые потенциальные инфекционные организмы не идентифицируются обычными методами посева, и даже в случаях септического артрита сообщается о высоком уровне ложноотрицательных результатов посева [10,12-15] Улучшение обнаружения инфекции было задокументировано в 1 исследовании путем инокуляции детской бутыли для гемокультур и инкубации в течение 24 часов перед посевом; однако этот вывод не удалось повторить в другом исследовании [13,14].
Если нет конкретных данных из анамнеза или физического осмотра, поиск возможного лежащего в основе внесуставного воспалительного, инфекционного или неопластического заболевания может включать широкий спектр тестов и быть довольно дорогим. Базовые тесты включают панель биохимии сыворотки, полный анализ клеток крови и анализ мочи, с планами наблюдения за любыми выявленными отклонениями. У многих пациентов с ИМПА результаты этих тестов соответствуют системному воспалению, например, лейкоцитоз, легкая нерегенеративная анемия и гипоальбуминемия [3, 5]. Во многих случаях также наблюдается умеренное повышение уровня щелочной фосфатазы в сыворотке неизвестной причины [3, 5].
Скрининг на инфекционные заболевания следует рассматривать на основе индивидуальных рисков заражения, включая географические районы, в которых животное жило или путешествовало, контакт с другими животными и потенциальными переносчиками болезней, а также историю профилактической медицины. Если первоначальная лабораторная работа не выявляет локализованных аномалий, следует рассмотреть возможность визуализирующих исследований, включая рентгенографию грудной клетки, брюшной полости и/или УЗИ, а также рентгенографию нескольких суставов, с последующим наблюдением за выявленными аномалиями.
Уход
Большинство случаев ИМПА лечат иммунодепрессантами. Однако эти лекарства могут быть противопоказаны при некоторых заболеваниях, которые проявляются сходными симптомами, таких как септический артрит, или не нужны при некоторых причинах вторичного ИМПА, например связанных с вакцинами или распространенными трансмиссивными заболеваниями. Авторы обычно ждут предварительных результатов посева суставной жидкости от 24 до 48 часов, прежде чем начинать иммуносупрессивную терапию. Поскольку трансмиссивные заболевания относительно редки в нашем регионе, мы обычно не ждем результатов внешних лабораторных тестов, прежде чем начинать иммуносупрессию, если тестирование в месте оказания медицинской помощи дает отрицательный результат.
Обезболивание
Пациентам с болью в суставах показаны обезболивающие препараты в ожидании результатов анализов для подтверждения диагноза. Хотя нестероидные противовоспалительные препараты (НПВП) являются одними из наиболее эффективных препаратов для лечения многих расстройств, связанных с болью в суставах, их следует в основном избегать в случаях, когда ИМПА считается вероятным дифференциальным диагнозом. Если используются НПВП, перед введением стероидных препаратов следует соблюдать период вымывания не менее 48 часов, что может привести к задержке эффективного лечения. Тем не менее, НПВП могут быть уместны в тех случаях, когда использование стероидов не предполагается, или когда окончательное лечение откладывается до получения результатов анализов или завершения курса антибиотиков при инфекции, не связанной с суставами.
Испытание доксициклина
Во многих случаях полиартрита, вторичного по отношению к трансмиссивным заболеваниям, таким как болезнь Лайма или риккетсиозы, положительный ответ на доксициклин (10 мг/кг перорально каждые 24 часа) ожидается в течение первой недели лечения [16]. Поэтому, если эти состояния диагностированы или сильно подозреваются, первоначальный подход может состоять из терапевтического испытания, ограниченного анальгетиками и доксициклином [10,16]. Если значительное улучшение отмечается в течение недели, лечение следует продолжать в течение 28 дней. Если через неделю улучшения не наступает, следует рассмотреть возможность проведения дополнительных диагностических исследований или иммуносупрессивной терапии.
Первопричинное патологическое состояние
Контроль причинного процесса заболевания является важной частью успешного лечения многих вторичных случаев ИМПА. Это может включать прекращение приема лекарств при подозрении на лекарственную реакцию, лечение инфекции, не связанной с суставами, антибиотиками, контроль сопутствующих желудочно-кишечных проблем или удаление или лечение опухолевых поражений. Некоторые случаи вторичного ИМПА могут разрешиться, когда разрешится лежащий в основе иммунный триггер. В частности, сообщалось, что IMPA, связанный с недавней вакцинацией или введением сульфаниламидов, разрешается всего за 3 дня без иммуносупрессивной терапии [17,18]. Также важно признать, что, как и при многих других иммуноопосредованных заболеваниях, нелеченый основной иммунный триггер может ограничивать эффективность иммуносупрессивной терапии в случаях ИМПА.
Иммунодепрессанты
Первичную (идиопатическую) ИМПА лечат иммунодепрессантами. Точно так же иммуносупрессия оправдана в случаях вторичной ИМПА, когда контроль основного состояния невозможен или клинические признаки сохраняются, несмотря на контроль основной проблемы. Глюкокортикоиды являются наиболее часто используемыми препаратами, и клиническое улучшение обычно наступает быстро. Типичный протокол начинается с иммунодепрессивной дозы преднизолона или преднизолона от 2 до 3 мг/кг/день. Однако это может представлять относительную передозировку для крупных собак. Частично основываясь на результатах недавнего исследования, авторы обычно начинают с дозы 2 мг/кг/день для собак <20 кг и 40 мг/м 2 /день для собак >20 кг.[19]
Альтернативные или дополнительные иммунодепрессанты могут быть использованы у пациентов с непереносимостью глюкокортикоидов или сопутствующими заболеваниями, которые предполагают неприемлемый риск для использования стероидов (например, застойная сердечная недостаточность, гиперадренокортицизм), или у пациентов, у которых не наблюдается клинического улучшения при монотерапии стероидами.
Иммунодепрессанты, обычно используемые при лечении ИМЛА, перечислены в ТАБЛИЦЕ 2 . Эти препараты можно использовать одновременно с глюкокортикоидами для ускорения процесса снижения дозы или для улучшения контроля заболевания в рефрактерных случаях. Было показано, что лефлуномид и циклоспорин являются эффективными монопрепаратами, альтернативными стероидам, для лечения первичного ИМПА у собак с полным ответом, наблюдаемым примерно в 60–70% случаев. [20,21].
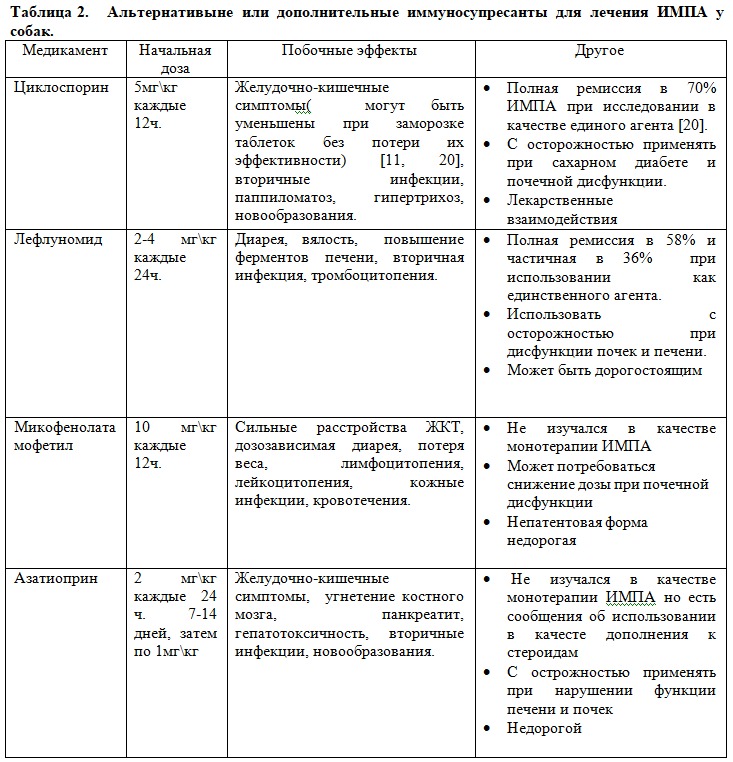
Независимо от используемых препаратов иммуносупрессивные дозы обычно продолжают принимать в начальной дозе, по крайней мере, в течение 2 недель после исчезновения клинических признаков (лихорадка, хромота, выпот в суставах). В идеале повторные пункции суставов выполняются для подтверждения разрешения воспаления, поскольку клинические признаки иногда уменьшаются до воспаления суставов, но это не всегда возможно из-за стоимости или восприятия клиентом инвазивности процедуры. Некоторые данные свидетельствуют о том, что уровни С-реактивного белка помогают дифференцировать ИМПА от остеоартрита и контролировать реакцию на терапию [22-24]. Измерение серийных уровней С-реактивного белка может помочь в выявлении некоторых случаев плохо контролируемого ИМПА, но этот метод имеет низкую чувствительность по сравнению с повторным артроцентезом, и авторы не используют измерение С-реактивного белка в этих случаях [24]. После клинической ремиссии дозу стероидов снижают постепенно (на 20-30%) каждые 3-4 недели с тщательным мониторингом признаков рецидива. Было предложено слишком быстрое снижение дозы лекарств, чтобы увеличить риск рецидива [10].Если используется более одного иммунодепрессанта, следует снижать дозу только одного из них за один раз. Решение о том, какое лекарство уменьшить в первую очередь, обычно основывается на причине использования нескольких лекарств, но чаще всего это стероид. В частности, если у пациента наблюдаются клинически значимые побочные эффекты, связанные с приемом стероида, или имеется другое состояние, на которое может отрицательно повлиять введение стероида, дозу стероида следует снизить в первую очередь. В большинстве случаев авторы выжидают не менее 3-4 недель после полного прекращения приема стероидов, прежде чем рассмотреть вопрос о снижении дозы другого иммунодепрессанта. Авторы, как правило, не пытаются полностью отучить пациентов от иммуносупрессивной терапии в течение по крайней мере 4–6 месяцев от начала лечения. Если есть рецидив, протокол лечения должен быть изменен обратно на самую последнюю эффективную дозу или комбинацию, хотя некоторым пациентам требуются еще более высокие дозы, чтобы восстановить контроль над болезнью. Некоторым пациентам может потребоваться очень длительная или пожизненная иммуносупрессивная терапия; в этом случае цель состоит в том, чтобы найти самую низкую эффективную дозу.
Вывод
Клинические проявления ИМПА у собак и, следовательно, диагностические и терапевтические стратегии сильно различаются. Одним из важных клинических советов является рассмотрение ИМПА в качестве дифференциальной диагностики в случаях без явных опухших или болезненных суставов. Даже при сильном подозрении на ИМПА часто трудно решить, какие тесты подходят для оценки возможного основного заболевания и как начать прием иммунодепрессантов. Тщательно продумав дифференциальный диагноз и относительные преимущества и риски различных вариантов диагностики и лечения, можно добиться успешных результатов для многих собак.
Литература
- Беннетт Д. Иммунологическое неэрозивное воспалительное заболевание суставов у собак. Идиопатический полиартрит собак. J Small Anim Pract 1987; 28:909-928.
2. Клементс Д.Н., Гир Р.Н., Таттерсолл Дж. и др. Иммуноопосредованный полиартрит I типа у собак: 39 случаев (1997-2002 гг.). ЯВМА 2004; 224:1323-1327.
3. Rondeau MP, Walton RM, Bissett S, et al. Нагноительная несептическая полиартропатия у собак. J Vet Intern Med 2005; 19: 654-662.
4. Жак Д., Козиниль Л., Буви Б. и др. Ретроспективное исследование 40 собак с полиартритом. Ветеринарная хирургия 2002; 31:428-434.
5. Stull JW, Evason M, Carr AP, et al. Иммуноопосредованный полиартрит собак: клинические и лабораторные данные 83 случаев в западной Канаде (1991-2001). Кан Вет Дж . 2008; 49:1195-1203.
6. Данн К.Дж., Данн Дж.К. Диагностические исследования у 101 собаки с гипертермией неизвестного происхождения. J Small Anim Pract 1998; 39: 574-580.
7. Баттерсби И.А., Мерфи К.Ф., Таскер С. и соавт. Ретроспективное исследование лихорадки у собак: лабораторные исследования, диагностика и влияние предшествующего лечения. J Small Anim Pract 2006; 47: 370-376.
8. Bennett D. Диагностика гипертермии неясного генеза. На практике
1995; 470-481.
9. Джонсон К.С., Макин А. Иммуноопосредованный полиартрит собак: часть 1: патофизиология. ДЖААХА 2012; 48:12-17.
10. Джонсон К.С., Макин А. Иммуноопосредованный полиартрит собак: часть 2: диагностика и лечение. ДЖААХА 2012;48:71-82.
11. Тейлор С.М. Артроцентез. В: Тейлор С.М., изд. Клинические методы лечения мелких животных . Сент-Луис, Миссури: Сондерс, 2009:189-201.
12. Клементс Д.Н., Оуэн М.Р., Мосли Дж.Р. и соавт. Ретроспективное исследование бактериального инфекционного артрита у 31 собаки. J Small Anim Pract 2005; 46: 171-176.
13. Шарф В.Ф., Льюис С.Т., Веллехан Дж.Ф. и др. Ретроспективная оценка эффективности выделения бактерий из синовиальной жидкости у собак с подозрением на септический артрит. Austr Vet J 2015;93:200-203.
14. Монтгомери Р., Лонг И., Милтон Дж. и др. Сравнение аэробной культуры, биопсии синовиальной оболочки и среды для культивирования крови при выявлении бактериального артрита у собак. Ветеринарная хирургия 1989; 18:300-303.
15. МакВильямс П.С., Фридрихс К.Р. Лабораторная оценка и интерпретация синовиальной жидкости. Vet Clin North Am Small Anim Pract 2003; 33: 153–178.
16. Littman MP, Goldstein RE, Labato MA, et al. Консенсус ACVIM для мелких животных о болезни Лайма у собак: диагностика, лечение и профилактика. J Vet Intern Med 2008; 20: 422-434.
17. Кон Б., Гарнер М., Любке С. и соавт. Полиартрит после вакцинации у четырех собак. Vet Comp Orthop Traumatol 2003; 16:6–10.
18. Giger U, Werner LL, Millichamp NJ, et al. Сульфадиазин-индуцированная аллергия у шести доберманов. ЯВМА 1985;186(5):479-84.
19. Нам А., Ким С.М., Чон Дж.В. и др. Сравнение формата дозирования на основе площади поверхности тела и массы тела для перорального введения преднизолона у собак мелких и крупных пород. Pol J Vet Sci 2017; 20:611-613.
20. Rhoades AC, Vernau W, Kass PH, et al. Сравнение эффективности преднизолона и циклоспорина при лечении собак с первичным иммуноопосредованным полиартритом. ЯВМА 2016; 248:395-404.
21. Колопи С.А., Бейкер Т.А., Мьюир П. Эффективность лефлуномида при лечении иммуноопосредованного полиартрита у собак: 14 случаев (2006-2008 гг.). ЯВМА 2010; 236:312-318.
22. Hillström A, Bylin J, Hagman R, et al. Измерение концентрации С-реактивного белка в сыворотке крови для дифференциальной диагностики гнойного артрита и остеоартрита у собак. BMC Vet Res 2016; 12:240.
23. Foster JD, Sample S, Kohler R, et al. Сывороточные биомаркеры клинического и цитологического ответа у собак с идиопатической иммуноопосредованной полиартропатией. J Vet Intern Med 2014; 28: 905-911.
24. Гробман М., Оути Х., Риндт Х. и др. Сывороточная концентрация тимидинкиназы 1, С-реактивного белка собак, гаптоглобина и витамина D у собак с иммуноопосредованной гемолитической анемией, тромбоцитопенией и полиартропатией. J Vet Intern Med 2017; 31: 1430-1440.