https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5603942/#b21-cvj_10_1073
Аннотация
Это исследование направлено на описание сигналов, клинических признаков, результатов магнитно-резонансной томографии (МРТ), анализа спинномозговой жидкости (CSF), лечения и исхода менингоэнцефаломиелита кошек неизвестной этиологии (FMUO). Был проведен ретроспективный анализ медицинских записей 16 кошек, отвечающих критериям включения плеоцитоза спинномозговой жидкости, отрицательных результатов полимеразной цепной реакции (ПЦР) в спинномозговой жидкости и характерных результатов МРТ. Средний возраст составил 9,4 года. Клинические признаки включали атаксию, проприоцептивный дефицит, судороги и спинальную гиперестезию. Количество ядерных клеток в спинномозговой жидкости было увеличено (медиана 70,7 клеток/мкл) с преимущественно смешанным плеоцитозом, а концентрация белка в спинномозговой жидкости была увеличена у 15 из 16 кошек. Магнитно-резонансная томография показала интрапаренхиматозные инфильтративные нечеткие образования в 13 случаях. Все кошки получали протокол лечения на основе кортикостероидов; дополнительные методы лечения включали ломустин, цитарабин и противосудорожные препараты. Легкие неврологические симптомы были зарегистрированы у 5 из 12 кошек, но 7 из 12 кошек при повторном обследовании были неврологически нормальными. Это первое исследование менингоэнцефаломиелита кошек (MUO), подчеркивающее менингоэнцефаломиелит кошек неизвестной этиологии (FMUO) как важный дифференциальный диагноз у кошек с вариабельной неврологической картиной. Прогноз при иммуномодулирующей терапии благоприятный.
Введение
Воспалительные заболевания центральной нервной системы (ЦНС) являются одной из наиболее частых причин неврологической дисфункции у собак и кошек и могут быть разделены на 2 широких класса: воспаление ЦНС инфекционного происхождения и воспаление ЦНС без идентифицируемой инфекционной причины [1,2]. Последний обычно называют менингоэнцефалитом или менингоэнцефаломиелитом неизвестной этиологии (MUO) [2,3]. По возможности нужно рассматривать расстройства, классифицированные в рамках MUO, индивидуально, поскольку клинические признаки и реакция на терапию, как правило, различаются между подгруппами. Однако, поскольку гистологический диагноз часто невозможен, обычно используется термин MUO [2].
В то время как MUO часто встречается у собак [2,4–7], у кошек было описано несколько случаев неинфекционного менингоэнцефаломиелита [8–10]. Bradshaw и соавт. [10] сообщили, что у 11% из 286 кошек с энцефалитом или менингитом не было признаков инфекционного агента, а 5 случаев MUO кошек были классифицированы Singh и соавт. [8] как негнойные или стероидочувствительные на основе характеристик спинномозговой жидкости (CSF) и реакции на лечение. Хотя основная причина MUO остается неясной, она, по-видимому, связана с аберрантным иммунным ответом, направленным против ЦНС [11], и, следовательно, иммуномодулирующая терапия является основой лечения MUO у собак. Информацции о протоколах лечения MUO (FMUO) кошек нет, хотя 2 случая были успешно вылечены преднизолоном [8]. Ответ на терапию и исход MUO у собак сильно различаются, в то время как данные о прогнозе у кошек с этим заболеванием в настоящее время неизвестны [2,9].
Эта статья представляет собой крупнейшее исследование предполагаемых случаев FMUO в литературе. Цель этого исследования состояла в том, чтобы описать сигнал, клинические признаки, результаты магнитно-резонансной томографии (МРТ), дополнительные диагностические тесты, анализ спинномозговой жидкости, лечение и исход FMUO, предоставив исходную информацию для дальнейших исследований, посвященных клинико-патологическим особенностям и оптимальным протоколам лечения.
Материалы и методы
Критерии отбора. Медицинские записи (с 2008 по 2016 год) кошек, представленных в Службу неврологии и нейрохирургии в Dick White Referrals, были ретроспективно рассмотрены. Критерии включения: плеоцитоз спинномозговой жидкости, характеристики МРТ, указывающие на воспалительные поражения, и отрицательные результаты полимеразной цепной реакции с обратной транскрипцией спинномозговой жидкости (RT-PCR) на инфекционные заболевания. При подозрении на неоплазию в качестве дифференциального диагноза выполнялись и анализировались дальнейшие визуализирующие и лабораторные тесты. В некоторых случаях проводились дополнительные диагностические исследования, в том числе серологическое исследование на Toxoplasma gondii. Кошки с историей введения стероидов до иссследования были исключены. Сигнализация, продолжительность клинических признаков, данные физикального и неврологического осмотра, нейроанатомическая локализация, количество ядерных клеток в спинномозговой жидкости и цитологические характеристики, концентрация белка в спинномозговой жидкости, результаты диагностической визуализации, включая МРТ, лечение, результаты неврологического обследования при повторном осмотре(ах), а также возникновение и терапии во время рецидива были зарегистрированы. Клинические признаки считались острыми, если они присутствовали в течение < 2 недель, и хроническими, если сообщалось в течение > 2 недель.
Анализ спинномозговой жидкости. Цереброспинальную жидкость собирали из большой цистерны во всех случаях. Анализ проводили в течение 1 часа после сбора. Количество ядерных клеток в спинномозговой жидкости классифицировали как: нормальное (< 5/мкл), умеренное (от 5 до 80/мкл), умеренное (от 81 до 500/мкл) или заметно (> 500/мкл) повышенное [8]. Уровни белка в спинномозговой жидкости классифицировались как: нормальные (<0,3 г/л), слегка (от 0,31 до 1,0 г/л), умеренно (от 1,1 до 3,0 г/л) или заметно (> 3,0 г/л) повышены [8]. Популяция ядерных клеток была классифицирована как нейтрофильная (> 50% нейтрофилов), мононуклеарная (> 80% мононуклеарных клеток), эозинофильная (> 50% эозинофилов) или смешанная (отсутствие преобладания какого-либо 1 типа клеток) [6]. Анализ RT-PCR на всех образцах CSF проводился во всех случаях на следующие инфекционные агенты: калицивирус кошек, герпесвирус кошек, Chlamydophila felis, Toxoplasma gondii, борнавирус, вирус лейкемии кошек, вирус иммунодефицита кошек, Leishmania infantum, парвовирус кошек (вирус панлейкопении) и коронавирус кошек.
Протокол магнитно-резонансной томографии. Магнитно-резонансную томографию выполняли с использованием сканера с постоянным магнитом 0,4 Тл (Hitachi Aperto Lucent 0,4 Тл; Hitachi Medical Systems, Веллингборо, Великобритания). Последовательности пульса различались, но у всех кошек были получены поперечные Т1WI, Т2WI, сагиттальные Т2WI FLAIR и постконтрастная гадотеровая кислота (Гадовист; Bayer Schering Pharma, Рединг, Великобритания), 0,1 ммоль/кг массы тела (МТ), внутривенно, поперечные Т1WI. Изображения были просмотрены сертифицированными радиологами, которые не знали об исследовании. Изображения оценивали на наличие поражений, характер поражения (очаговый, диффузный или многоочаговый) и его местоположение. Регистрировали наличие менингеального поражения. Края поражения описывались как четко очерченные, неровные или инфильтративные. О масс-эффекте свидетельствовали сглаживание борозд, смещение срединных структур, грыжа мозжечка (оценивалась на сагиттальной средней линии T2WI) или девиация/компрессия желудочковой системы. Т1WI до и после введения контраста сравнивали для оценки усиления контраста и описывали характер поглощения контраста.
Лечение. Лечение зависело от предпочтений клинициста и требований индивидуального случая. Все кошки получали клиндамицин (Antirobe; Zoetis, Лондон, Великобритания), 12,5 мг/кг МТ, перорально, каждые 12 часов с ожиданием результатов ПЦР на инфекционное заболевание спинномозговой жидкости в течение 5–7 дней. Всех кошек лечили протоколом на основе кортикостероидов (только дексаметазон, дексаметазон с последующим преднизолоном или только преднизолон). Первоначально использовались дозы иммуносупрессивных стероидов, включая преднизолон (Prednicare; Animalcare, Йорк, Великобритания), 1 мг/кг МТ, перорально, каждые 12 часов и дексаметазон (Дексаметазон; Аспен, Реддич, Великобритания), 0,2–0,3 мг/кг МТ, перорально, каждые 24 часа. Терапию кортикостероидами постепенно снижали, обычно уменьшая дозу вдвое или дозировку каждые 2–3 недели, если не наблюдалось рецидива. Дополнительные иммуномодулирующие терапии включали ломустин (Lomustine; Nova Laboratories, Wigston, UK), 10 мг/кошку, перорально, однократно в 1-й день, и цитарабин (Cytarabine; Pfizer, Sandwich, UK), 50 мг/м2, подкожно, каждые 12 часов, всего 4 дозы, по усмотрению врача. Противосудорожные препараты использовались у всех кошек с судорожными припадками и включали фенобарбитал (Фенолептил; Animalcare), 1 мг/кг МТ, перорально, каждые 12 часов, леветирацетам (Кеппра; UCB Pharma, Брюссель, Бельгия), 10 мг/кг МТ, перорально, каждые 8 часов, или диазепам (Diazemuls; Actavis, Барнстейпл, Великобритания), 0,5 мг/кг массы тела, в/в, в случае судорог.
Последующее наблюдение и результат. Повторное обследование было запланировано для всех кошек через 2-3 недели после выписки. Были зарегистрированы клинические и неврологические данные, а также любые изменения в текущих протоколах лечения. Последующее наблюдение было на усмотрение врачей и владельцев.
Полученные результаты
Клинические, неврологические и диагностические данные приведены в таблице 1 (Приложение 1).
Сигнализация
Шестнадцать кошек соответствовали критериям включения. Средний возраст составил 9,4 года (диапазон: от 10 месяцев до 12 лет). Кошки были домашними короткошерстными или длинношерстными (14), персидскими (1) и сиамскими (1).
Клинические признаки. В 3 случаях владельцы не указали появление клинических признаков. Клинические признаки были зарегистрированы как острые у большинства кошек (14/16). Системные признаки включали притупление психического статуса (5/16), анорексию (4/16) и лихорадку (3/16). Наиболее частыми отклонениями при неврологическом обследовании были атаксия (8/16), парезы со сниженными постуральными реакциями (8/16) и спинальная гиперестезия (6/16) (дополнительную информацию см. в Таблице 1). Генерализованные (4/16) или парциальные (2/16) припадки были зарегистрированы у 6 кошек. Нистагм наблюдался у 3 кошек, а снижение или отсутствие зрачковых рефлексов на свет (PLR) и/или реакции угрозы были отмечены у 3 кошек. Локализация, основанная на неврологическом обследовании, была мультифокальной в головном мозге в 4 случаях, переднем мозге в 4 случаях, мультифокальной в ЦНС в 3 случаях и мультифокальной в спинном мозге в 5 случаях.
Анализ спинномозговой жидкости. Количество ядерных клеток в спинномозговой жидкости было слегка увеличено у 12 из 16 и умеренно увеличено у 4 из 16 кошек (медиана: 62,2 клеток мкл, диапазон: от 6 до 344) (таблица 1). Плеоцитоз был смешанным в 5/16, лимфоцитарным в 5/16, мононуклеарным в 3/16, нейтрофильным в 2/16 и эозинофильным в 1/16 случаев. Белок цереброспинальной жидкости был повышен в 15/16 случаях, так как проба была недостаточной для измерения в 1 случае. Концентрация белка была слегка увеличена у 12/16 (медиана: 0,50 г/л, диапазон: от 0,21 до 22,25 г/л). Результаты ПЦР в спинномозговой жидкости на T. gondii и кошачий коронавирус были доступны в 3 из 16 случаев, и все они были отрицательными.
Данные магнитно-резонансной томографии. Результаты МРТ (Таблица 2 (Приложение 2)) коррелировали с нейроанатомической локализацией в 14/16 случаях. У 10 из 16 кошек МРТ выявила мультифокальные поражения ЦНС. Единичные поражения наблюдались у 4 кошек, а усиление контраста мозговых оболочек только в оставшихся 2 случаях. Поражения, как правило, были изоинтенсивными или гипоинтенсивными на T1W, гиперинтенсивными на T2W и различались по поглощению контраста. Поражения были нечеткими у 9 кошек и инфильтративными у 3 кошек. Легкая субтенториальная или мозжечковая грыжа наблюдалась в 2 из 16 случаев. Гидроцефалия наблюдалась только у 1 кошки.
При визуализации спинного мозга поражения были внутри паренхиматозными в 3/5 и вне паренхиматозными в 2/5 случаях. Менингеальное контрастное усиление наблюдалось в 2/5 случаев.
Вспомогательные диагностические исследования: общий анализ крови (CBC) и биохимия сыворотки выполнялись во всех случаях; лейкоцитоз был зарегистрирован у 5 кошек. Серологическое исследование на токсоплазму было проведено у 9 из 16 кошек; результаты не подтверждали недавнюю или активную инфекцию (высокий титр IgM) ни в одном случае, но у 3 кошек (кошки 4, 9, 11) результаты указывали на предыдущее воздействие (высокий титр IgG, но титр IgM в пределах нормы). Другие диагностические исследования, в том числе УЗИ брюшной полости (5/16 кошек), рентгенограммы раздутой грудной клетки (2/16 кошек), не выявили значительного сопутствующего заболевания ни у одной кошки.
Лечение. Только дексаметазон давали 9/16 кошкам, дексаметазон с последующим преднизолоном давали 4/16 кошкам, а только преднизолон — 3/16 кошкам. Пять кошек получали дополнительную иммуномодулирующую терапию, включая цитарабин у 3 кошек и ломустин у 2 кошек. Противосудорожные препараты использовались у всех кошек с приступами, включая фенобарбитон (4/6) и леветирацетам (2/6). Две кошки, госпитализированные по поводу кластерных припадков/эпилептического статуса, при поступлении получали диазепам в сочетании с фенобарбитал (1 случай) или леветирацетамом (1 кошка) для контроля судорог.
Исход. Средняя продолжительность госпитализации составила 6,8 дня (диапазон: от 3 до 12 дней). Все кошки дожили до выписки (таблица 1). Последующее наблюдение было недоступно в 4 случаях. Медиана окончательного наблюдения составила 5,2 месяца (диапазон: от 0 до 16 месяцев) после обращения. При первом повторном осмотре 7 из 12 кошек были нормальными при неврологическом обследовании и оставались бессимптомными при всех последующих повторных осмотрах (2, 5, 9, 10 и 12 месяцев) (таблица 1). У остальных кошек, представленных для повторного осмотра, при первом повторном осмотре были выявлены стойкие слабые неврологические симптомы, включая легкую атаксию тазовых конечностей, легкий тетрапарез, перемежающуюся гиперестезию позвоночника и снижение частоты (снижение > 50%) парциальных припадков. Дальнейшее наблюдение за 2 из этих кошек не проводилось, в то время как у остальных 3 кошек при последующих повторных осмотрах были зарегистрированы стабильные или улучшенные клинические признаки. Одна кошка получила повышенную дозу дексаметазона, что привело к полному и долгосрочному исчезновению клинических признаков (последнее наблюдение через 10 мес). У этой кошки через 1 год после ремиссии, через несколько дней после плановой вакцинации, развился рецидив. Лечение было успешно прекращено у оставшихся 2 кошек без ухудшения состояния (последнее наблюдение через 9 и 15 месяцев).
Обсуждение
Это исследование представляет собой наиболее подробное описание подозреваемого FMUO. Полученные данные указывают на большое сходство с MUO у собак, но также и на некоторые важные различия, особенно в прогнозе. Кошки среднего и старшего возраста, по-видимому, подвергались наибольшему риску, поскольку средний возраст в этом исследовании составлял 9,4 года, хотя заболевание наблюдалось у гораздо более старых и более молодых кошек. Возраст собак, пораженных MUO, также может сильно различаться (от 6 месяцев до 12 лет) [7, 12, 13]; однако чаще сообщалось о молодых собаках или собаках среднего возраста [2,7,13]. Породной или половой предрасположенности не наблюдалось, в отличие от исследований на собаках, описывающих предрасположенность самок [2,7]; однако размер выборки этого исследования вряд ли будет достаточным для выявления гендерной предрасположенности к MUO у кошек.
Клинические признаки FMUO, как правило, соответствовали распространению поражения ЦНС. Появление неврологических симптомов в большинстве случаев было острым, как и при MUO у собак [12,14], хотя продолжительность симптомов может быть недооценена у кошек из-за их темперамента и часто меньшего времени, проведенного в непосредственной близости от владельцев. Судорожная активность, парциальная или генерализованная, была основной причиной появления в этом исследовании, подобно данным, полученным при многоочаговом гранулематозном энцефалите (GME) у собак [7] и NE у мопсов [13] и йоркширских терьеров [2]. Наши результаты подчеркивают, что MUO кошек является важным дифференциальным диагнозом судорог, особенно у кошек молодого и среднего возраста, у которых в анамнезе не было судорог.
Внутричерепное многоочаговое заболевание было наиболее распространенной нейроанатомической локализацией, о чем сообщалось у собак [2] и в ранее описанных случаях предполагаемого FMUO [8]. Внутричерепная локализация была наиболее распространенной (50%), с равным распределением между многоочаговыми и локализованными в переднем мозге, в то время как у 31% кошек было подозрение на поражение только позвоночника, что соответствует проценту фокальных проявлений MUO у собак [12].
В большинстве случаев в этом исследовании регистрировался умеренный плеоцитоз CSF; предыдущие отчеты о подозрении на FMUO показывают высокое количество клеток при гнойном заболевании, но более низкое количество клеток при негнойном заболевании [8]. Плеоцитоз спинномозговой жидкости сильно варьирует в MUO собак и может быть даже нормальным [2]. Тяжесть плеоцитоза спинномозговой жидкости, по-видимому, не коррелировала с тяжестью заболевания или прогнозом в этом исследовании, как у собак, пораженных MUO [9]. Более того, тип плеоцитоза не коррелировал с длительностью клинических признаков, представляя собой очень вариабельную распространенность лейкоцитов в CSF с острым началом в большинстве случаев. Поскольку плеоцитоз спинномозговой жидкости не является специфичным для MUO, важно сопоставить его с характерными результатами магнитно-резонансной томографии (МРТ) и отрицательными результатами инфекционного заболевания, также как были выбраны критерии включения в это исследование.
Характеристики магнитно-резонансной томографии, наблюдаемые в большинстве случаев в этом исследовании, аналогичны таковым у собак MUO, в которых результаты МРТ кажутся вариабельными, с преобладанием фокальных или мультифокальных, нечетко очерченных гиперинтенсивных поражений на T2WI [4,6, 15]. Гиперинтенсивность T2WI имеет умеренную чувствительность (68%) и высокую прогностическую ценность (100%) для воспалительной спинномозговой жидкости у собак [4]; однако сообщалось, что контраст гадолиния повышает чувствительность МРТ для выявления воспалительных поражений [15,16]. В этом исследовании у 2 кошек (случаи 1 и 13) с нечеткими очагами на Т2WI как изоинтенсивными наблюдалось выраженное усиление контраста, что помогло выявить и определить характер патологии головного мозга. Интересно, что большинство внутричерепных поражений поражало только белое вещество, что соответствует предыдущим данным у собак с GME [6] и некротизирующим лейкоэнцефалитом (NLE) [2]. К сожалению, последовательность FLAIR, которая, как сообщалось ранее, повышает чувствительность МРТ [15], была доступна не во всех случаях. Однако у этих 2 кошек очаги контрастного усиления также были гетерогенно гиперинтенсивными в FLAIR. Потребуются дальнейшие исследования для лучшего выяснения МРТ-характеристик предполагаемого MUO у кошек и возможных различий МРТ с инфекционным энцефалитом.
Недавно было высказано предположение, что лимбический энцефалит кошек (FLE) имеет первичную иммуноопосредованную этиологию, поскольку у 36% кошек с парциальными припадками с орофациальным поражением были обнаружены повышенные концентрации антител против комплексов потенциалзависимых калиевых каналов (VGKC-комплексы) [17] . Диагноз подозрения на FLE основывается на клинических признаках, результатах МРТ, характеризующихся типичной двусторонней гипо- и изоинтенсивностью T1 и гиперинтенсивностью T2 гиппокампа, а также плеоцитарной спинномозговой жидкостью [17]. Ни у одной из представленных здесь кошек не было обнаружено сходных клинических и магнитно-резонансных данных; однако основная иммуноопосредованная воспалительная этиология может привести к общим биохимическим характеристикам с FMUO. Следовательно, необходимы дальнейшие исследования для выяснения возможной общей этиологии и тестирования сыворотки на VGKC-комплексы у пациентов с FMUO.
Все кошки в этом исследовании получали только дексаметазон, дексаметазон с последующим преднизолоном или только преднизолон; однако размер выборки был слишком мал для статистических сравнений. Кортикостероиды снижали в течение нескольких недель или месяцев, в зависимости от ответа на лечение, и у 2 кошек потребовалась длительная (> 10 мес) терапия. Дополнительные иммуномодулирующие препараты, включая цитарабин и ломустин, применялись у 5 кошек вместе с кортикостероидами без побочных эффектов, и во всех случаях на момент последнего наблюдения была зарегистрирована полная ремиссия симптомов. Использование цитарабина и ломустина отражало предпочтения клиницистов, в основном из-за отсутствия ответа на кортикостероиды во время госпитализации; однако полная информация об этом клиническом решении отсутствует в записях. Цитарабин и ломустин широко используются для химиотерапии нескольких видов рака, включая лимфому [14, 18–20]. Более того, цитарабин [21, 22] и ломустин [23] также применялись в качестве иммуномодулирующей терапии в дополнение к стероидам при MUO у собак, и поэтому в настоящем исследовании они использовались из-за их иммуномодулирующего эффекта у кошачьих пациентов с подозрением на MUO. Дозировки этих двух препаратов были основаны на предыдущих описаниях их применения у кошек [14, 18–20]. Из-за отсутствия окончательного гистопатологического диагноза может быть разумно рассматривать инфильтративную неоплазию, включая лимфому, в качестве основного дифференциального диагноза для этих пациентов, а ремиссию клинических признаков — как вторичную по отношению к использованию химиотерапии у пациентов с потенциально ошибочным диагнозом. Хорошая эволюция клинических признаков у кошек, о которой сообщалось в настоящем исследовании, открывает одну из основных ключевых дискуссий о MUO как у собак, так и у кошек, а именно отсутствие окончательного гистопатологического диагноза. Биопсия головного мозга не является одним из рутинных тестов для диагностики MUO у животных, а у кошек небольшой объем мозга может быть особенно сложным. MUO у собак обычно считается прижизненным диагнозом, и необходимы дальнейшие исследования для повышения уверенности в результатах диагностических тестов, особенно МРТ и анализе спинномозговой жидкости, при диагностике MUO у кошек.
Несмотря на небольшое количество случаев с длительным наблюдением, это исследование впервые в ветеринарной литературе предлагает прогностические данные для MUO кошек. Все кошки выжили до выписки, и более половины кошек, представленных для повторного обследования, находились в клинической ремиссии через 2–3 недели после постановки диагноза и оставались таковыми до окончательного наблюдения (от 2 до 12 мес). Среднее время до окончательного наблюдения составило 5,2 месяца, и вполне возможно, что у зарегистрированных кошек рецидив мог произойти в более поздний срок, чем последний осмотр в этом исследовании. Общий прогноз у кошек с воспалительной спинномозговой жидкостью считается неблагоприятным: 77% кошек выживают менее 1 года (8,24). Однако сообщалось о воспалительном ликворе при невоспалительных состояниях, включая новообразования, и при инфекционных заболеваниях ЦНС, включая инфекционный перитонит кошек (FIP), что может иметь важное влияние на неблагоприятный прогноз для кошек с воспалительными поражениями ЦНС [4, 5,24,25]. Настоящее исследование подчеркивает хороший прогноз при MUO у кошек, а воспалительный CSF у кошек не всегда должен быть связан с неблагоприятным исходом. Более того, у 12/16 кошек, за которыми было возможно последующее наблюдение, MUO был связан с лучшим среднесрочным прогнозом, чем у собак с MUO. Прогноз у собак, пораженных MUO, оценивался в нескольких исследованиях, в некоторых из которых число случаев было таким же, как в настоящем исследовании [26], а в других — больше [27]. Тем не менее, прогноз остается осторожным или неблагоприятным [9, 12, 28] у большинства пораженных собак, для которых смерть была зарегистрирована у 50–56 % [9, 28] собак, получавших лечение.
Это исследование имеет ряд ограничений. Протокол регламентированного лечения не применялся в связи с ретроспективным характером исследования и необходимостью индивидуального ведения случаев MUO. Непредсказуемость рецидивов, различия в тяжести заболевания и вариабельность ответа на лечение означают, что проспективные исследования схем лечения не всегда практичны или этичны. Отсутствие последующего наблюдения в 25% случаев было разочарованием.
Гистопатологического подтверждения MUO не проводилось, поскольку все кошки выжили. Поэтому невозможно определить точную природу воспалительных состояний, поражающих этих кошек. Однако MUO собак обычно считается прижизненным диагнозом, и целью этого исследования было описание клинических особенностей кошек с этим заболеванием, а не определение его происхождения. Основываясь на гистологических изменениях, несколько авторов заподозрили вирусные энцефалиты, не относящиеся к FIP, как основную причину большинства случаев кошачьего менингоэнцефалита [8,13,14]. Хотя возможно, что причиной заболевания в этом исследовании были ложноотрицательные результаты ПЦР CSF или агенты, на наличие которых ПЦР CSF не тестировалась (включая вирус Западного Нила и вирус болезни Ауески), это маловероятно, учитывая улучшение/устранение клинических признаков с иммуносупрессивной терапией. В идеале у всех кошек должна быть проведена серология T. gondii для дальнейшего исключения инфекции.
Необходимы дальнейшие исследования MUO у кошек, чтобы определить прогноз и ответ на лечение, а также выделить соответствующие гистологические изменения и возможную этиологию. Долгосрочный прогноз MUO у кошек остается неизвестным, поэтому необходимы крупномасштабные проспективные рандомизированные исследования для сравнения различных протоколов лечения кошачьего MUO, как описано для собачьего MUO.
В заключение, MUO является важной дифференциальной диагностикой различных неврологических симптомов у кошек. Возрастной, половой или породной предрасположенности не было, хотя в этом исследовании чаще поражались кошки молодого и среднего возраста. Начало заболевания обычно было острым и в большинстве случаев совместимо с многоочаговыми внутричерепными поражениями, хотя наблюдались очаговые поражения головного и спинного мозга. Плеоцитоз спинномозговой жидкости и характеристики МРТ, как правило, аналогичны большинству сообщений о MUO у собак, со смешанной или лимфоцитарной спинномозговой жидкостью и нечеткой гиперинтенсивностью на последовательностях T2W и FLAIR, которые показывают неоднородное поглощение контраста. Из этого исследования нельзя сделать окончательных выводов относительно лечения, но иммуносупрессивная терапия оказалась успешной для достижения быстрой полной или частичной ремиссии во всех случаях, которые были доступны для последующего наблюдения. Таким образом, прогноз, по-видимому, лучше, чем для собачьей MUO, но показаны дальнейшие исследования кошачьей MUO, чтобы лучше понять ее происхождение, лечение и исход.
Сноски
Использование этой статьи ограничено одной копией для личного изучения. Любой, кто заинтересован в получении репринтов, должен связаться с офисом CVMA (gro.vmca-amvc@nothguorbh) для получения дополнительных копий или разрешения на использование этого материала в другом месте.
Использованная литература
1. Platt S, Freeman AC. Neck and back pain. In: Platt S, Olby N, editors. BSAVA Manual of Canine and Feline Neurology. 4th ed. BSAVA Press; 2013. pp. 252–270. [Google Scholar]
2. Granger N, Smith PM, Jeffery ND. Clinical findings and treatment of non-infectious meningoencephalomyelitis in dogs: A systematic review of 457 published cases from 1962 to 2008. Vet J. 2010;184:290–297. [PubMed] [Google Scholar]
3. Windsor RC, Sturges BK, Vernau KM, Vernau W. Cerebrospinal fluid eosinophilia in dogs. J Vet Intern Med. 2009;23:275–281. [PubMed] [Google Scholar]
4. Lamb CR, Croson PJ, Cappello R, Cherubini GB. Magnetic resonance imaging findings in 25 dogs with inflammatory cerebrospinal fluid. Vet Radiol Ultrasound. 2005;46:17–22. [PubMed] [Google Scholar]
5. Bohn AA, Wills TB, West CL, Tucker RL. Cerebrospinal fluid analysis and magnetic resonance imaging in the diagnosis of neurologic disease in dogs: A retrospective study. Vet Clin Pathol. 2006;35:315–320. [PubMed] [Google Scholar]
6. Cherubini GB, Platt SR, Anderson TJ, et al. Characteristics of magnetic resonance images of granulomatous meningoencephalomyelitis in 11 dogs. Vet Rec. 2006;159:110–115. [PubMed] [Google Scholar]
7. Muñana KR, Luttgen PJ. Prognostic factors for dogs with granulomatous meningoencephalomyelitis: 42 cases (1982–1996) J Am Vet Med Assoc. 1998;15:1902–1906. [PubMed] [Google Scholar]
8. Singh M, Foster DJ, Lamb WA. Inflammatory cerebrospinal fluid analysis in cats: Clinical diagnosis and outcome. J Feline Med Surg. 2005;7:77–93. [PMC free article] [PubMed] [Google Scholar]
9. Lowrie M, Smith PM, Garosi L. Meningoencephalitis of unknown origin: Investigation of prognostic factors and outcome using a standard treatment protocol. Vet Rec. 2013;172:527. [PubMed] [Google Scholar]
10. Bradshaw JM, Pearson GR, Gruffydd-Jones TJ. A retrospective study of 286 cases of neurological disorders of the cat. J Comp Pathol. 2004:112–120. [PMC free article] [PubMed] [Google Scholar]
11. Kipar A, Baumgartner W, Vogl C, Gaedke K, Wellman M. Immunohistochemical characterisation of inflammatory cells in brains of dogs with granulomatous meningoencephalitis. Vet Pathol. 1998;35:43–52. [PubMed] [Google Scholar]
12. Talarico LR, Schatzberg SJ. Idiopathic granulomatous and necrotising inflammatory disorders of the canine central nervous system: A review and future perspectives. J Small Anim Pract. 2010;51:138–149. [PubMed] [Google Scholar]
13. Levine JM, Fosgate GT, Porter B, Schatzberg SJ, Greer K. Epidemiology of necrotizing meningoencephalitis in Pug dogs. J Vet Intern Med. 2008;22:961–968. [PMC free article] [PubMed] [Google Scholar]
14. Rassnick KM, Williams LE, Kristal O, et al. Lomustine for treatment of mast cell tumors in cats: 38 cases (1999–2005) J Am Vet Med Assoc. 2008;232:1200–1205. [PubMed] [Google Scholar]
15. Young BD, Fosgate GT, Holmes SP, et al. Evaluation of standard magnetic resonance characteristics used to differentiate neoplastic, inflammatory, and vascular brain lesions in dogs. Vet Radiol Ultrasound. 2014;55:399–406. [PubMed] [Google Scholar]
16. Negrin A, Lamb CR, Cappello R, Cherubini GB. Results of magnetic resonance imaging in 14 cats with meningoencephalitis. J Feline Med Surg. 2007;9:109–116. [PMC free article] [PubMed] [Google Scholar]
17. Pakozdy A, Halasz P, Klang A, et al. Suspected limbic encephalitis and seizure in cats associated with voltage-gated potassium channel (VGKC) complex antibody. J Vet Intern Med. 2013;27:212–214. [PubMed] [Google Scholar]
18. Dutelle AL, Bulman-Fleming JC, Lewis CA, Rosenberg MP. Evaluation of lomustine as a rescue agent for cats with resistant lymphoma. J Feline Med Surg. 2012;14:694–700. [PubMed] [Google Scholar]
19. Hamilton TA, Morrison WB, DeNicola DB. Cytosine arabinoside chemotherapy for acute megakaryocytic leukemia in a cat. J Am Vet Med Assoc. 1991;199:359–61. [PubMed] [Google Scholar]
20. Podell M, DiBartola SP, Rosol TJ. Polycystic kidney disease and renal lymphoma in a cat. J Am Vet Med Assoc. 1992;201:906–909. [PubMed] [Google Scholar]
21. Zarfoss M, Schatzberg S, Venator K, et al. Combined cytosine arabinoside and prednisone therapy for meningoencephalitis of unknown origin in 10 dogs. J Small Anim Pract. 2006;47:588–595. [PubMed] [Google Scholar]
22. Menaut P, Landart J, Behr S, Lanore D, Trumel C. Treatment of 11 dogs with meningoencephalomyelitis of unknown origin with a combination of prednisolone and cytosine arabinoside. Vet Rec. 2008;162:241–245. [PubMed] [Google Scholar]
23. Uriarte A, Thibaud JL, Gnirs K, Blot S. Lomustine treatment in non-infectious meningoencephalitis in 8 dogs. J Vet Intern Med. 2008;22:509. [Google Scholar]
24. Marioni-Henry K, Vite CH, Newton AL, Van Winkle TJ. Prevalence of diseases of the spinal cord of cats. J Vet Intern Med. 2004;18:851–8. [PubMed] [Google Scholar]
25. Gunn-Moore D, Reed N. CNS disease in the cat: Current knowledge of infectious causes. J Feline Med Surg. 2011;13:824–836. [PubMed] [Google Scholar]
26. Rand JS, Parent J, Percy D, Jacobs R. Clinical, cerebrospinal fluid, and histological data from thirty-four cats with primary noninflammatory disease of the central nervous system. Can Vet J. 1994;35:174–181. [PMC free article] [PubMed] [Google Scholar]
27. Quesnel AD, Parent JM, McDonell W, Percy D, Lumsden JH. Diagnostic evaluation of cats with seizure disorders: 30 cases (1991–1993) J Am Vet Med Assoc. 1997;210:65–71. [PubMed] [Google Scholar]
28. Tipold A, Jaggy A. Steroid responsive meningitisarteritis in dogs: Long-term study of 32 cases. J Small Anim Pract. 1994;35:311–316. [Google Scholar]
Таблица 1
Сигнализация, клинические и диагностические данные, лечение и исход 16 случаев менингоэнцефаломиелита у кошек
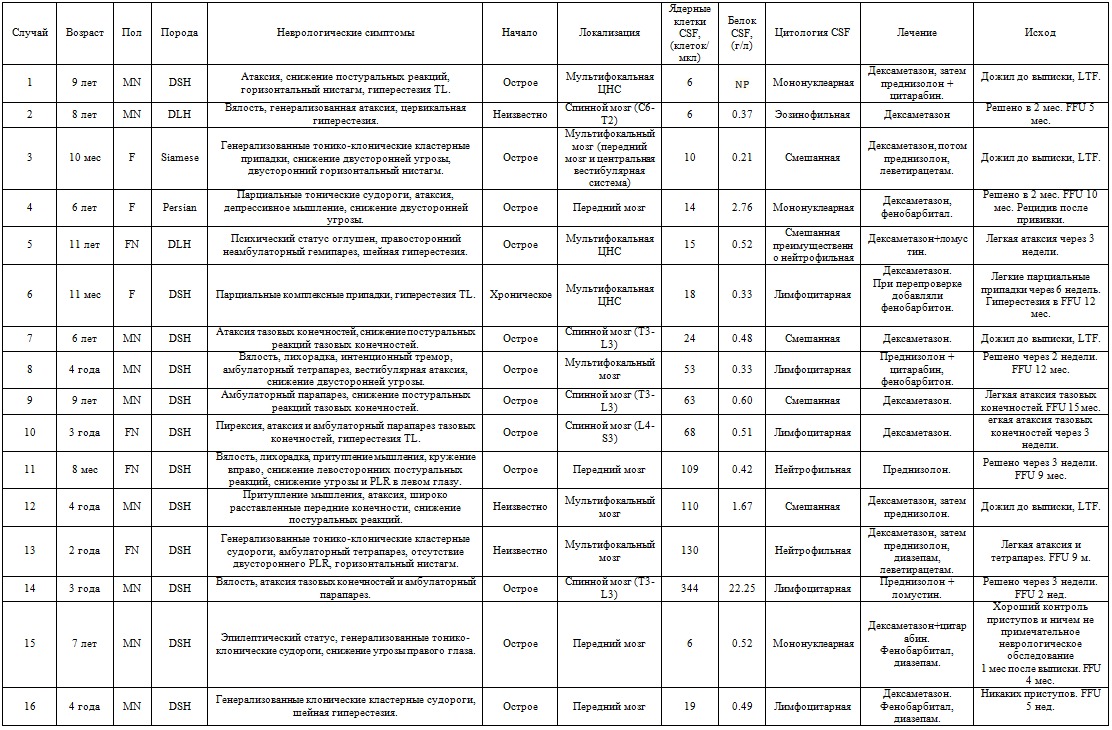 М — самец (некастрированный); MN — самец (кастрированный); F — самка (нестерилизованная); FN — сука (стерилизованная); TL — грудопоясничный; PLR — зрачковый рефлекс на свет; LTF — потерян для последующего наблюдения; FFU — окончательное наблюдение;; DSH — домашняя короткошерстная; ЦНС — центральная нервная система.
М — самец (некастрированный); MN — самец (кастрированный); F — самка (нестерилизованная); FN — сука (стерилизованная); TL — грудопоясничный; PLR — зрачковый рефлекс на свет; LTF — потерян для последующего наблюдения; FFU — окончательное наблюдение;; DSH — домашняя короткошерстная; ЦНС — центральная нервная система.
Приложение 2
Таблица 2
Результаты магнитно-резонансной томографии в 16 случаях менингоэнцефаломиелита у кошек
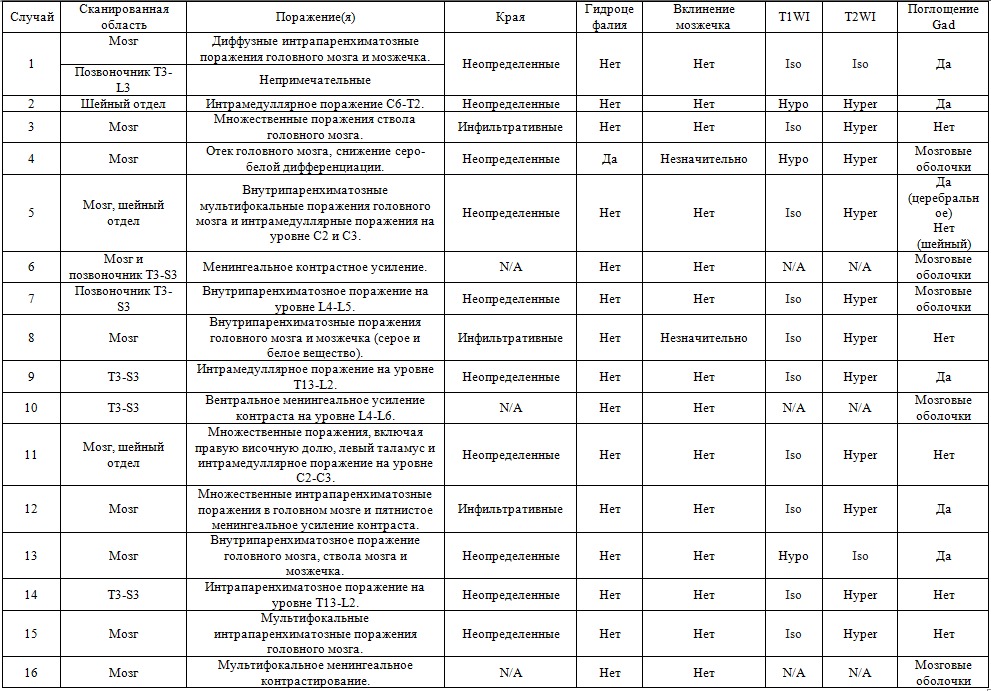 Gad — гадотеровая кислота; N/A — недоступно
Gad — гадотеровая кислота; N/A — недоступно