Сокращения:
ГПВ – гипоплазия воротной вены
ПССА–портосистемные сосудистые аномалия
МВД –микроваскулярная дисплазия
ПСШ – портосистемный шунт
Введение
В норме у собак около 70% кровотока в печень поступает по портальному кровообращению, а остальные 30% — по печеночной артерии. Гепатопетлевой кровоток из портальной системы входит в портальную триаду, пересекает синусоиды и возвращается в большой круг кровообращения по печеночным венам.
У собак существует целый спектр врожденных печеночных сосудистых аномалий, затрагивающих портальную сосудистую систему печени.
Макроскопические портосистемные сосудистые аномалии возникают в виде одиночных сосудов внутри (внутрипеченочные) или вне печени (внепеченочные – Рисунок 1-4 [9]), которые направляют кровь из воротной вены в большой круг кровообращения. [1].
Гипоплазия портальной вены — врожденный порок развития, при котором присутствуют внутрипеченочные микроскопические шунты, в результате чего кровь не течет через синусоиды печени [2].
Гипоплазия воротной вены (ГПВ) (также известная как микроваскулярная дисплазия (МВД)), (Allenet al, 1999; Center, 2008; Christiansenet al, 2000; Rothuzienet al, 2006; Schermerhornet al, 1996), первоначально называлась микроваскулярной дисплазией (МВД), но в 2004 году Группа по стандартизации патологии печени Всемирной ветеринарной ассоциации мелких животных (the World Small Animal Veterinary Association (WSAVA) Liver Standardization Group) переименовала МВД на синдром первичной гипоплазии воротной вены (гипоплазия воротной вены) поскольку ассоциация считала МВД частью группы врожденных заболеваний (за исключением портосистемных сосудистых аномалий — ПССА), связанных с гипоплазией воротной вены, приводящих к гипоперфузии печеночной паренхимы. Хотя ясно, что у некоторых собак с врожденным портоваскулярным заболеванием имеется истинная гипоплазия (атрезия) внепеченочной воротной вены, неясно, все ли собаки с синдромом, признанным МВД, имеют гипопластические сосуды. [1].
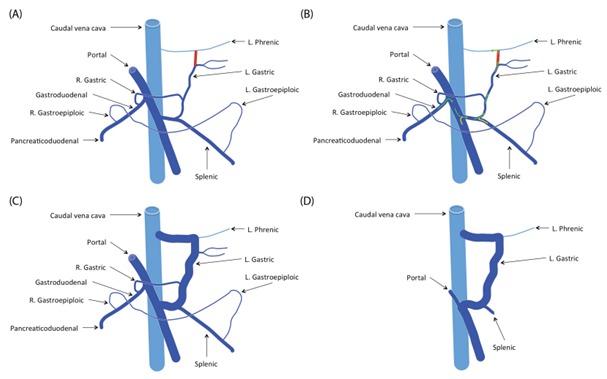 Рисунок 1 . Шунт между левой желудочной веной и левой диафрагмальной веной в левом желудочно-диафрагмальном шунте [9]
Рисунок 1 . Шунт между левой желудочной веной и левой диафрагмальной веной в левом желудочно-диафрагмальном шунте [9]
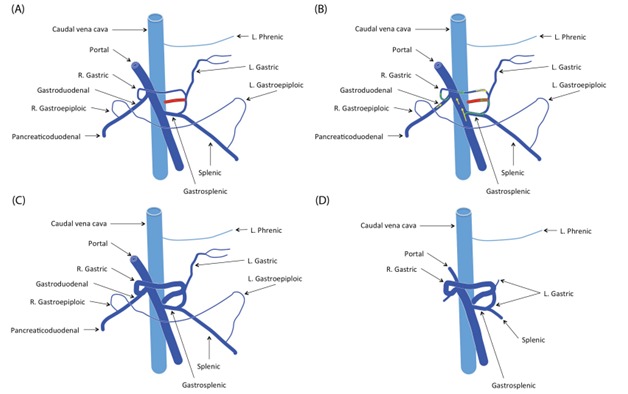 Рисунок 2 . Шунт между левой желудочной веной и предпеченочной КПВ в шунте, включающий правую желудочную вену и КПВ [9]
Рисунок 2 . Шунт между левой желудочной веной и предпеченочной КПВ в шунте, включающий правую желудочную вену и КПВ [9]
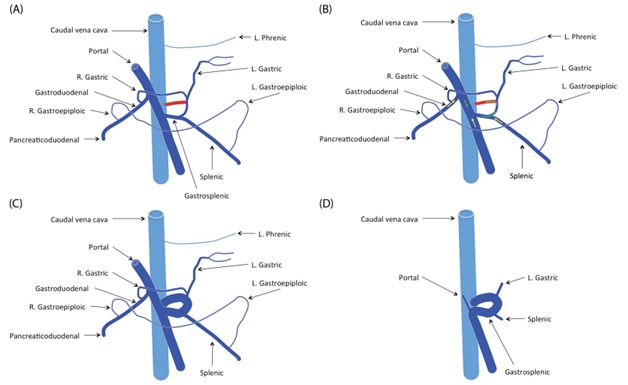 Рисунок 3. Шунт между левой желудочной веной и предпеченочной КПВ в сплено-кавальном шунте [9]
Рисунок 3. Шунт между левой желудочной веной и предпеченочной КПВ в сплено-кавальном шунте [9]
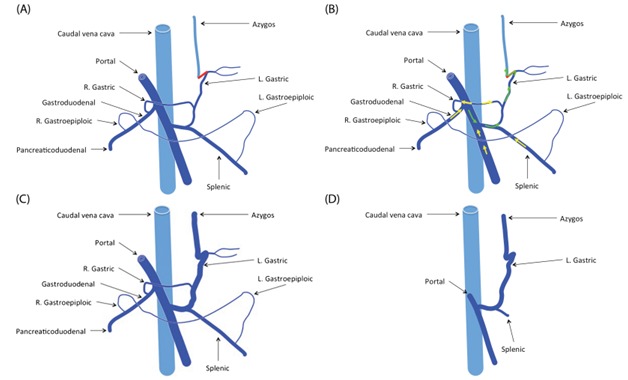 Рисунок 4. Шунт между левой желудочной веной и непарной веной в левом желудочно-непарном шунте [9]
Рисунок 4. Шунт между левой желудочной веной и непарной веной в левом желудочно-непарном шунте [9]
Предрасположенность
Гипоплазия воротной вены/микроваскулярная дисплазия может возникать независимо или одновременно с портосистемными сосудистыми аномалиями. Некоторые собаки мелких пород подвержены повышенному риску ГПВ/МВД, в том числе многие из тех же пород, предрасположены к ПССА. Эти породы включают керн-терьеров, тибетских спаниелей, мальтийских болонок, гаванских болонок, йоркширских терьеров, норфолк-терьеров и миниатюрных шнауцеров.
Инициативная группа по генотипированию мелких пород собак, проводимая в Корнельском университете, установила, что макроскопические или микроскопические порто васкулярные аномалии встречаются у 30-80% этих пород. Было обнаружено, что частота ГПВ/МВД превышает ПССА 30:1 во всех изученных породах. Данные генотипирования предполагают, что признак ПССА/ГПВ/МВД является аллельным и может представлять собой родовую мутацию родителя. Тип передачи признака аутосомно-неполный пенетрантный или полигенный [1].
Согласно ретроспективному исследованию Christiansenetal. др. (2000), 70% собак с ГПВ — суки. Однако в исследовании Allen etal. (1999) нет половой предрасположенности.
Клинические признаки:
У некоторых собак ГПВ/МВД может протекать бессимптомно, заболевание обычно диагностируют в ходе рутинного скрининга или диагностической оценки несвязанных проблем со здоровьем или при рутинном обследовании у предрасположенных пород. [3]
У Собак с ПСШ, собак с ГПВ и собак, у которых присутствуют обе патологии, могут быть неврологические, желудочно-кишечные симптомы и симптомы со стороны мочевыводящих путей (Watson, 1997 год; Аллен и др., 1999; Кристиансен и др., 2000).
В ходе ретроспективного исследования Christiansenetal. (2000) было установлено, что неврологические симптомы (начиная от вялости до печеночной энцефалопатии) являются наиболее распространенными.
Анорексия, рвота и диарея являются наиболее частыми желудочно-кишечными симптомами.
У некоторых собак могут образовываться камни в мочевом пузыре. (Phillips и др., 1996; Аллен и др., 1999; Кристиансен и др., 2000).
У собак с ГПВ тяжесть клинических признаков вариабельна и зависит от количества пораженных долей печени (Christiansenetal., 2000).
Лабораторная диагностика:
По результатам общего анализа крови у собак с ГПВ/МВД в отличие от собак с ПСШ обычно нет микроцитоза (Allen et al.,1999).
По результатам биохимического анализа крови собак с ГПВ/МВД уровень сывороточного альбумина в норме или может быть незначительно снижен; ферменты печени могут быть нормальными или повышенными, в зависимости от тяжести заболевания. [2]
Гипераммониемия не зарегистрирована у собак с ГПВ/МВД без сопутствующей портальной атрезии или ПССА. [4]
У собак с ГПВ/МВД отмечается повышение желчных кислот в сыворотке крови. [1]
Уровень протеина С в плазме может помочь в дифференциации ПССА и ГПВ/МВД, поскольку он обычно является субнормальным при ПССА (протеин C <70% у 88% собак) и нормальным при МВД (протеин C ≥ 70% у 95% собак) (Toulzaet al, 2006). Низкие уровни протеина С при ПССА, вероятно, отражают гипоперфузию печени, а не синтетическую недостаточность.
Визуальная диагностика
— УЗИ брюшной полости – нет макроскопически шунтирующих сосудов; размер печени субъективно нормальный или незначительно уменьшен; опытный оператор может заподозрить портальную гипоперфузию, которая может варьироваться в зависимости от доли.
— Портогафия (рисунок 5-6) – малозаметные аномалии притупления мелких ветвей воротной вены, длительный «румянец» контраста из-за усечения третичных ветвей воротной вены, задерживающих контраст.
— Магнитно-резонансная ангиография и компьютерная томографическая ангиография — оба метода визуализации, доступные для сканирования анатомии сосудов печени. Микрососудистые аномалии у собак с ГПВ считаются слишком маленькими, чтобы их можно было адекватно визуализировать.
— Колоректальная или спленопортальная сцинтиграфия – нормальная или слегка повышенная фракция шунта при МВД; исключает макроскопический шунт (врождённый ПСШ, приобретённый ПСШ); колоректальная сцинтиграфия может демонстрировать нерегулярную перфузию доли печени при МВД. [4]
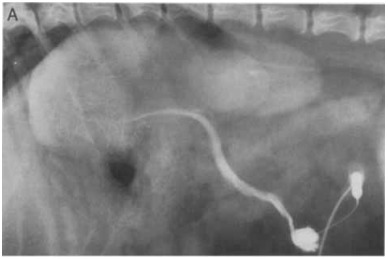 Рисунок 5A [8]
Рисунок 5A [8]
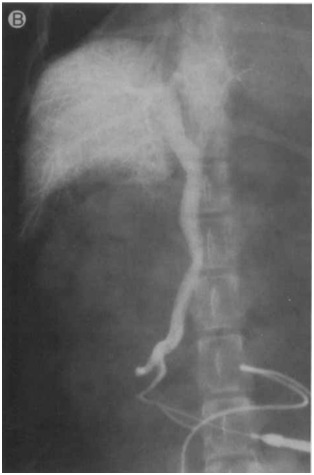 Рисунок 5B [8]
Рисунок 5B [8]
Рисунок 5. (А) Латеральная проекция, (В) вентро-дорсальная проекция, венозная портограмма собаки с гепатопортальной микрососудистой дисплазией, показывающая отчетливое затемнение сосудов в дорсальной (хвостатой) доле печени и неполное затемнение других долей.
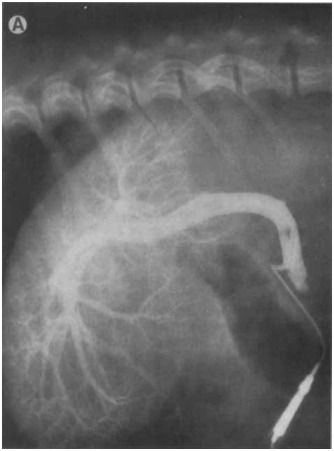 Рисунок 6A [8]
Рисунок 6A [8]
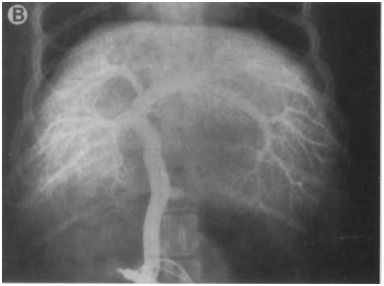 Рисунок 6B [8]
Рисунок 6B [8]
Рисунок 6. (А) Латеральная проекция, (В) вентро-дорсальная проекция, венозная портограмма с многократной экспозицией тех же собак, венозная портография с многократной экспозицией обеспечивает превосходное затемнение портальной сосудистой сети.
Постановка окончательного диагноза
Для постановки окончательного диагноза требуется проведение гистологического исследования, результаты которого необходимо рассматривать в сочетании с результатами клинических исследований.
Биопсию печени необходимо отбирать из нескольких долей печени, так как МВД не оказывает одинакового влияния на все доли печени; избегать отбора проб хвостатой доли, так как она получает перфузию из первой ветви воротной вены.
При поведении тонкоигольной биопсии под контролем УЗИ может быть получено недостаточно ткани для постановки окончательного диагноза. [4]
По результатам гистологического исследования обнаруживают гепатоцеллюлярную атрофию, уменьшение портальной сосудистой сети с/без гиперплазии портальных артериол или гипертрофию паренхиматозных печеночных артериол, пролиферацию желчных протоков. Рисунок 7. [5]

Рисунок 7. [5] Гистологические данные первичной гипоплазии воротной вены в печени. Гипоплазия воротной вены, сужение печеночной дольки, пролиферация желчных протоков и расширение артериол. В междольковой соединительной ткани отмечают выраженное уменьшение портальной сосудистой сети и умеренную гиперплазию артериол. (A) Суженная печеночная долька (среднее увеличение, 400×). (Б) Гипоплазия междольковых вен. Стрелка указывает на гипертрофию паренхиматозных печеночных артериол (большое увеличение, 1000×). (C) Стрелка указывает на гипертрофию паренхиматозных печеночных артериол (большое увеличение в 1000 раз).
Клинический случай
Собака породы йоркширский терьер в возрасте 7лет 9 месяцев обратился в ветеринарную клинику Биота.
Владелец описывал признаки боли у собаки, когда ее берут на руки, также у животного возникала дрожь, собака принимала позу «молящегося», терапия папаверином и анальгином давала улучшение до 5 часов, на момент приёма в клинике собака принимала препарат габапентин. Владелец описывал лечение панкреатита 2 месяца назад. Питание кормом для собак. Состояние сознания владелец описал как измененное — собака стала более пугливой, изменилось поведение и режим дня, по дому стала передвигаться вдоль стен.
На осмотре проприоцептивный дефицит, на левой тазовой конечности выражен сильнее, снижение рефлекса отдергивания на конечностях. Боли при пальпации позвоночного столба не отмечалось.
По результатам общего анализа крови: незначительно повышен гематокрит (HCT) – 60,0 % при норме 39, 0 – 56,0%, повышен показатель – средний объём эритроцита (MCV)- 74,9фл при норме 62,0 – 72,0фл, незначительно понижен показатель – среднее содержание гемоглобина (MCH) 19,1пг при норме 20,0 – 25,0пг.
По результатам биохимического анализа крови незначительно повышен показатель АСТ — 70,03 ед/л при норме 10,0 – 50,0ед/л.
Уровень желчных кислот до и после нагрузки в норме.
Аммиак значительно завышен 153мкмоль/л при норме 28,56-85,68 мкмоль/л.
Результаты ультразвукового исследования:
Ao.-.3,9мм,..CVC.-.3,9мм,..PV.-.2,3.
Соотношение..PV/Ao..-..(2,3мм/3,9мм)..-..0,58.
Ультразвуковые признаки могут быть характерны для хронического воспалительного процесса желчного пузыря — стенка 1,59мм, неровная неоднородная; в полости желчного пузыря визуализируется гипоэхогенное содержимое, занимающее 1/3 объёма желчного пузыря (билиарный сладж).
Был поставлен предварительный диагноз: портосистемный шунт.
Дифференциальные диагнозы включали:
— гипоплазия портальной вены (микроваскулярная дисплазия);
— менингоэнцефалит;
— опухоль головного мозга.
Было рекомендовано проведение портографии.
До проведения портографии выписано симптоматическое лечение:
1.Метронидозол 10мг/кг, каждые 12 часов, после еды.
- Дюфалак 0,5мл/кг внутрь, каждые 12 часов.
- Урсосан 10мг/кг 1 раз в 24 часа.
- Промышленная диета с низким содержанием белка.
5.Паглюферал 1 — по 2мг/кг каждые 12 часов.
Перед проведением портографии было проведено ЭХОКГ сердца, по результатам которого установлен эндокардиоз 1 стадии без признаков ремоделирования сердца.
Анестезиологический протокол включал в себя премедикацию телазол 1,5мг/кг, индукцию пропофолом и поддержание изофлюраном.
Ход операции: после срединной лапоратомии удаления жира серповидной связки, проведена катетеризация брыжеечной вены, проведено контрастирование препаратом омнипак с последующей рентгенографией.
Закрытие лапоратомной раны по стандартной методике.
 Рисунок 8. Портограмма, латеральная проекция
Рисунок 8. Портограмма, латеральная проекция
Портограмма характерна для нормальной портальной системы.
Проведен забор материала на гистологию путём краевой резекции левой латеральной доли печени.
Отчет по гистологии
Гистопатологическое описание, печень: Центральные вены диффузно нечеткие. Портальные области иногда содержат несколько желчных протоков (гиперплазия желчных протоков) и множественные извилистые кровеносные сосуды (гиперплазия артериол и воротной вены и / или гипоплазия). Кроме того, гепатоциты иногда вакуолизируются (вакуолярная дегенерация гепатоцитов, стероидный тип). Рисунок 10
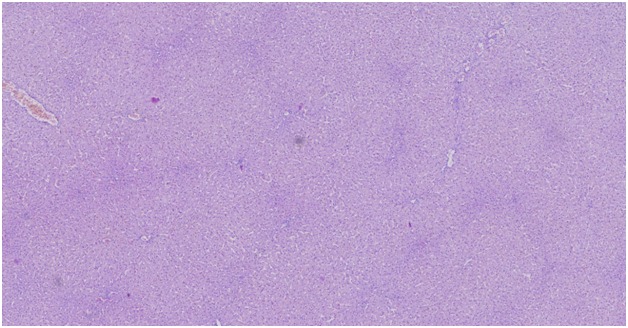 Рисунок 10
Рисунок 10
Морфологический диагноз, печень: венозная гипоплазия, артериолярная гиперплазия и гиперплазия желчных протоков, диффузные, с легкой вакуолярной гепатопатией.
Диагноз, печень: сосудистая аномалия печени.
Pathologist: Tatjana Lazic, DVM, MS, PhD, Diplomate American College of Veterinary Pathology — Anatomic Pathology
Собака хорошо восстановилась после проведенной портографии, на момент снятия швов через 14 дней жалоб на самочувствие не отмечалось.
Обсуждение:
Без анамнеза, клинических данных или результатов визуализации часто невозможно отличить первичную гипоплазию воротной вены от врожденного портосистемного шунта только с помощью гистологического исследования. У собак сообщалось об одновременной первичной гипоплазии воротной вены и врожденных портосистемных шунтах.[6]
В недавнем исследовании 2019 года [7] у 125 собак с прогрессирующим заболеванием сосудов печени первоначальный диагноз был подтвержден в 89,3% случаев, когда после биопсии печени возникло подозрение на портосистемный шунт, что свидетельствует о чувствительности биопсии печени в таких случаях. В этом исследовании животные были разделены на животных с внутрипеченочными шунтами, с внепеченочными шунтами и с печеночной микрососудистой дисплазией — гипоплазией воротной вены. Случаи микрососудистой дисплазии без явного шунтирования чаще всего наблюдались у йоркширских терьеров. В дополнение к более классическим гистологическим признакам компрессии долек, множественных участков извилистых артериол в портальных триадах и отсутствию портальных вен в триадах это исследование также выявило устойчивые, но менее распространенные гистологические поражения. Приблизительно в 20% случаев внутри- или внепеченочного шунтирования наблюдается гипертрофия гладких мышц вокруг поддольковых вен, которая возрастала до 80% в случаях микрососудистой дисплазии. Фиброз центральных вен отмечен в 22% внепеченочных шунтов и микроваскулярной дисплазии, но в 60% внутрипеченочных шунтов. Кальциноз был виден примерно у 2% животных с развивающимся заболеванием сосудов печени, но, по-видимому, не был результатом дистрофического обызвествления самой стенки сосуда. Наконец, образование липогранулемы оказалось наиболее частым при внепеченочных шунтах (50%), но 20% или менее в двух других категориях, и имело тенденцию быть более заметным у пожилых собак в исследовании.
В ретроспективном исследовании [5] были проанализированы клинические записи и данные биопсии печени 48 собак с заболеваниями печени, которые были обследованы в частной ветеринарной больнице в Японии в период с апреля 2011 г. по март 2014 г. По результатам исследования из 48 собак у 28 собак (58,3%) была диагностирована первичная гипоплазия воротной вены. В группе с первичной гипоплазией воротной вены все 16 собак были без клинических признаков, кроме повышенных ферментов печени, имели хорошее здоровье в течение как минимум 5 лет после постановки диагноза. Семь собак, у которых были обнаружены только желудочно-кишечные симптомы, были здоровы в течение как минимум 3 лет после постановки диагноза. Из двух собак с неврологическими и желудочно-кишечными симптомами одна умерла через 639 дней после постановки диагноза и одна через 1550 дней после постановки диагноза в результате гипоальбуминемии и гипогликемии из-за приобретенных портосистемных коллатералей. Одна собака с только неврологическими симптомами была здорова в течение как минимум 3 лет после постановки диагноза. Две собаки с вялостью находились в хорошем состоянии в течение как минимум 1460 дней после постановки диагноза. Средняя продолжительность жизни в группе с первичной гипоплазией воротной вены составила более 5 лет. У двух собак, которые умерли, на момент постановки диагноза были обнаружены приобретенные портосистемные коллатерали.
По данным найденных литературных источников при ГПВ/МВД без сопутствующей портальной атрезии или ПССА не отмечается повышение уровня аммония. В представленном нами клиническом случае уровень аммиака в крови был повышен у пациента с ГПВ, на данный момент это первая публикация о данной лабораторной находке.
Список литературы
1. Portal Vein Hypoplasia (Microvascular Dysplasia). Andrea N. Johnston, Ithaca, New York. Cynthia R.L. Webster, Grafton, Massachusetts. —18 июл. 2016 г.
2. Portal vein hypoplasia in dogs. N. Devriendt, M. Or, D. Paepe, E. Vandermeulen, M. Hesta, H.E.V. De Cock, H. de Rooster. —сентябрь 2014 г.Vlaams Diergeneeskundig Tijdschrift 83 (5): 234-239
DOI: 10.21825/vdt.v83i5.16635
3. https://www.petmd.com/dog/conditions/genetic/c_dg_hepatoportal_microvascular_dysplasia
4. Hepatoportal Microvascular Dysplasia. (2019). Blackwell’s Five-Minute Veterinary Consult Clinical Companion, 836–842. doi:10.1002/9781119376293.ch128
постоянная ссылка на статью: sci-hub.ru/10.1002/9781119376293.ch128
5. Akiyoshi, M., Hisasue, M., &Akiyoshi, M. (2017). Clinicopathological Findings and Prognosis in Canine Cases Diagnosed As Primary Hypoplasia of the Portal Vein. Frontiers in Veterinary Science, 4. doi:10.3389/fvets.2017.00224
постояннаяссылканастатью: sci-hub.ru/10.3389/fvets.2017.00224
6. Schermerhorn T, Center SA, Dykes NL, Rowland PH, Yeager AE, Erb HN, Oberhansley K, Bonda M. Characterizaton of hepatoportal microvascular dysplasia in a kindred of Cairn terriers. J Vet Intern Med. 1996;10(4):219-230.
7. Sobczak-Filipiak M, Szarek J, Badurek I, Pdmanabhan J. Trebacz P, Januchta-Kurmin M, Galanty M. Retrostpective liver histomorphological analysis in dogs in instances of clinical suspicion of congenital portosystemic shunt. J Vet Res 2019; 63:243-249.
8. Schermerhorn T, Center SA, Dykes NL, Rowland PH, Yeager AE, Erb HN, Oberhansley K, Bonda M. Characterizaton of hepatoportal microvascular dysplasia in a kindred of Cairn terriers. J Vet Intern Med. 1996; 10(4):219-230.
9. White, R.N., Shales, C. and Parry, A.T. (2017), New perspectives on the development of extrahepatic portosystemic shunts. J Small Anim Pract, 58: 669-677. https://doi.org/10.1111/jsap.12728