Ссылка https://doi.org/10.3390/cells11030571
Аннотация: Опухоли тучных клеток (мастоцитомы) (МСТs) являются распространенными новообразованиями у собак, и методы лечения этих заболеваний включают хирургическое вмешательство, полихимиотерапию и таргетную терапию ингибиторами тирозинкиназы. Эта статья посвящена оценке ответа и побочных эффектов лечения мастоцитом у собак иматиниба мезилатом (IM) по сравнению с традиционной терапией с использованием винбластина и преднизолона (VP). В исследование были включены двадцать четыре собаки; 13 животных лечили IM и 11 — VP. Образцы опухолевой ткани были отправлены на гистологическую диагностику, классификацию и иммуноокрашивание KIT. Ответ на лечение оценивали с помощью томографических измерений по критериям VCOG. Нежелательные явления были классифицированы в соответствии с критериями VCOG-CTCAE. В группах IM и VP были собаки с аналогичными породами, полом, возрастом, локализацией MCT, стадиями и профилями метастазов в лимфатических узлах. Большинство MCT имели степень 2/низкую и имели KIT-паттерны 2 и 3. Частота объективных ответов (ORR) была значительно выше (30,79%) в группе IM, чем в группе VP (9,09%). Нежелательные явления (AE) при IM во всей группе были 1 класса, что значительно отличается от VP. В заключение, IM показал лучшую ORR и менее серьезные побочные эффекты по сравнению с VP, что представляет собой подходящий вариант лечения мастоцитом у собак.
Ключевые слова: с-KIT; мезилат иматиниба; иммуногистохимия; тучноклеточная опухоль (мастоцитома); преднизолон; винбластин.
- Введение
Опухоли тучных клеток (МСТs) представляют собой гемопоэтические новообразования, которые обычно встречаются у собак. Они составляют 7–21% опухолей кожи, зарегистрированных у этого вида [1,2]. В последнее время были проведены сравнения новообразований тучных клеток собак и человека, и была подчеркнута важность сравнительной онкологии: системный мастоцитоз человека и опухоли тучных клеток собак разделяют многие характеристики, такие как диагностические подходы, мутации c-KIT и даже методы лечения [3]. Большинство опухолей тучных клеток собак имеют различные мутации в гене c-KIT, включая внутренние тандемные дупликации в околомембранной области [4,5], что приводит к активации KIT, приводящей к усиленной и неконтролируемой пролиферации клеток.
MCT у собак сильно различаются с точки зрения их биологического поведения, начиная от почти доброкачественных опухолей до высокоинвазивных и метастатических опухолей [6]; большинство авторов утверждают, что эти опухоли всегда следует считать злокачественными. Существует две системы гистологической оценки MCT у собак. В системе Патнаика MCT классифицируются как классы 1, 2 или 3, где опухоли 3 степени соответствуют более агрессивным опухолям с большим метастатическим потенциалом, и поэтому более важны с клинической точки зрения [7]. Более поздняя двухуровневая система классификации Киупеля классифицирует MCT на опухоли высокой или низкой степени злокачественности [8]. Гистологическая степень, местоположение и статус мутации c-KIT являются хорошо установленными прогностическими факторами, которые отличают МСТ высокого и низкого уровня [9,10].
Лечение собак с MCT состоит либо из полихимиотерапии, либо с применением ингибиторами тирозинкиназы, такими как тоцераниб, маситиниб или, реже, иматиниб [11–13]. Решение о методе лечения основывается на клиническом и гистопатологическом диагнозах, а также на стадии болезни. Варианты лечения опухолей тучных клеток: хирургия, химиотерапия, лучевая терапия или комбинированное лечение. Хирургическое иссечение является методом выбора при тучноклеточных опухолях, представляющих собой одиночные массы, расположенные в областях, допускающих широкое иссечение, с вовлечением или без вовлечения регионарных лимфатических узлов [14]. Опухоли тучных клеток очень инвазивные и для лечения этих заболеваний показаны широкие хирургические поля. В случаях множественных опухолей, неоперабельных опухолей или при наличии отдаленных метастазов, применятся другие указанные методы лечения [15]. Химиотерапия опухолей тучных клеток показана для лечения опухолей высокой степени злокачественности на поздних клинических стадиях, для уменьшения объема или для предотвращения местного рецидива в случае неполного иссечения. [16]. Стандартный протокол химиотерапии для лечения тучноклеточных опухолей включает в себя сочетание винбластина с преднизоном [17].
Рецепторы с тирозинкиназной активностью (RTK) являются широко исследуемыми клеточными белками, которые часто не связаны у людей и животных с опухолевыми заболеваниями [18,19]. О гетерогенной экспрессии KIT, в дополнение к VEGFR-2 и PDGFRB, сообщается в МСТ собак [20,21].
Иматиниб мезилат (IM) представляет собой мезилатную соль иматиниба, ингибитора тирозинкиназы с известной противоопухолевой активностью. Иматиниб связывается с внутриклеточным карманом, расположенным внутри тирозинкиназы (ТК), тем самым ингибируя связывание АТФ, фосфорилирование и последующую активацию рецепторов роста и их нижестоящих путей передачи сигнала. Этот агент ингибирует RTK, кодируемые c-KIT и рецептором тромбоцитарного фактора роста (PDGFR) онкогены. Иматиниб является селективным ингибитором RTK, используемым для лечения стромальных опухолей желудочно-кишечного тракта у людей [22] и MCT у собак [11–13], так как эти опухоли имеют аномальные экспрессии конститутивной тирозинкиназы, что приводит к нарушению регуляции роста клеток [5].
IM используется для лечения MCT у собак [11–13]; однако эффективность этого средства по сравнению с традиционная химиотерапия винбластином и преднизоном (VP) еще не определена. Таким образом, это исследование было направлено на оценку ответа на лечение мезилатом иматиниба (IM) по сравнению с традиционной терапией винбластином и преднизолоном (ВП) у собак с MCT. Это исследование также было направлено на сравнение побочных эффектов лечения IM и VP.
- Материал и методы.
2.1. Этическое одобрение, собаки-пациенты и критерии включения
Это исследование было одобрено Комитетом по этике использования животных (CEUA) Школы ветеринарной медицины и зоотехники Университета Сан-Паулу, ФМВЗ-УСП (№ процесса 2092/2010). Владельцы собак подписали формы информированного согласия.
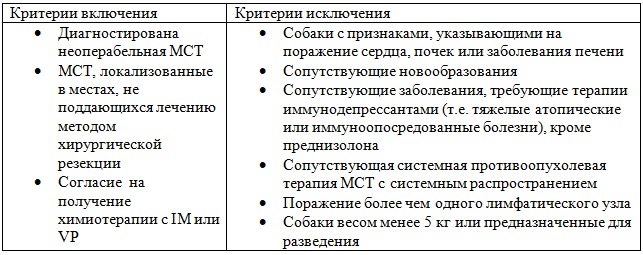
В общей сложности 24 собаки, принадлежащие клиентам, были размещены в клинике для мелких животных Школы ветеринарной медицины и зоотехники Университета Сан-Паулу (FMVZUSP). Критерии включения и исключения перечислены в таблице 1.
Таблица 1. Критерии включения и исключения для собак с MCT
2.2. Диагностика и постановка
Клиническая оценка и стадирование включали сбор полных данных, связанных с медицинскими показаниями, анамнез, физикальное обследование, общий анализ крови (CBC, включая дифференциальный анализ и количество тромбоцитов), биохимический анализ сыворотки крови, анализ мочи, абдоминальное УЗИ и регионарное цитологическое исследование лимфатических узлов, если это возможно.
Диагноз был поставлен на основании гистологического анализа пункционных биоптатов. Образцы опухоли были собраны для гистологического и иммуногистохимического анализа. Их фиксировали в 10% формалине и обычным способом обрабатывали для включения в парафин. Секции 5 мкм помещали на предметные стекла и окрашивали гематоксилином и эозином для диагностики. Гистологические препараты были исследованы одним ветеринарным патологоанатомом (M.L.Z.D.).
У собак с множественными MCT для оценки выбирали самую большую опухоль. Опухоли оценивались по системам оценок Патнаика [7] и Киупеля [8].
Образцы опухолей подвергали экстракции ДНК и РНК для анализа с-KIT мутации (амплификации ПЦР и секвенирование) и полуколичественное выражение с-KIT и лиганд с-KIT с помощью ПЦР в реальном времени. Результаты не были окончательными и, следовательно, не включены в этом исследовании.
2.3. Иммуногистохимия
Срезы кожных МСТ собак использовали для иммуногистохимического исследования оценки локализации белка KIT, как описано ранее [22].
Для подготовки препаратов для иммуногистохимии были получены срезы толщиной 5 мкм из парафиновых блоков, приклеенных к силанизированным предметным стеклам, депарафинизированным и регидратированным. Восстановление антигенов для КИТ проводили путем нагревания гистологических срезов в 1% цитратном буфере раствора рН 6,0, в течение 3,5 мин в скороварке. После охлаждения предметные стекла обрабатывали эндогенной пероксидазой в течение 30 мин в 6% растворе перекиси водорода с последующим промыванием предметных стекол проточной водой в течение 10 мин и дистиллированной водой в течение 5 мин. Гистологические срезы инкубировали с первичными антителами анти-KIT 1 (Dako Denmark A/S, 1:100) и разведенные в буфере PBS, содержащем 1% бычий альбумин (BSA; Sigma® A9647) и 0,1% азид натрия (NaN3) в течение 30 мин при 37 ◦C в печи, затем 18 часов при 4 ◦C во влажной камере (ночь), затем путем промывания PBS и инкубации с конъюгированным полимером Super Picture Poly HRP в течение 30 мин в духовке при 37 ◦С. Вскрытие проводили с помощью раствора, содержащего диаминобензол (DAB+Chromogen, Dako Carpinteria, Калифорния, США). Контрастное окрашивание проводилось гематоксилином. Затем проводили обезвоживание в спиртовых ваннах (70%, 95% и абсолютного спирта дважды по 5 мин) с последующей диафанизацией в растворе спирта в смеси с ксилолом, две ксилоловые ванны по 10 мин каждая и установка в синтетической смоле и на покровном стекле.
Окрашивание KIT и локализацию белка оценивали, как описано Киупелем и др. [22]. Локализация белка KIT оценивалась одним ветеринарным патологоанатомом (М.Л.З.Д.). KIT-положительные клетки подсчитывали вручную с помощью световой микроскопии на приборе Nikon.микроскоп (40-кратное увеличение) и программном обеспечении Image Pro Plus (Image Pro Plus 4.5®, Media Кибернетика, Сильвер Спринг, Мэриленд, США). Каждому МСТ был назначен один из трех вариантов окрашивания паттернов, основанных на самом высоком паттерне окрашивания (паттерны окрашивания I, II или III), присутствующем в не менее 10% популяции неопластических клеток (оценивается на основе 100 неопластических клеток в поле высокой мощности) или присутствуют в больших скоплениях опухолевых клеток внутри опухоли [22].
2.4. Протоколы лечения
Собак случайным образом распределили в одну из двух групп, получавших разное лечение. Собаки в группе IM (13 животных) получали ежедневные пероральные дозы (10 мг/кг) иматиниба мезилата (Гливек 100 или 400 мг, Novartis Pharma AG, Базель, Швейцария) в течение 8 недель. Собаки в группе VP (11 животных) получала 4 еженедельных, а затем 4 двухнедельных курса винбластина (Фаубластина 10 мг, Либбс), вводимый в дозе 2,0 мг/м2 путем внутривенной болюсной инъекции в сочетании с ежедневным пероральным преднизолоном (метикортен 5 или 20 мг, Schering-Plough S.A., Kenilworth, NJ,США) вводили сначала в дозе 2 мг/кг, затем снижали дозу и отменили в течение курса лечения 12 недель [20]. Собакам также назначали дифенгидрамин (2 мг/кг перорально, два раза в день) и омепразол (0,5 мг/кг перорально один раз в день), чтобы избежать последствий возможной дегрануляции МСТ.
2.5. Оценка ответа на лечение
Ответ на лечение оценивали в соответствии с критериями оценки ответа солидных опухолей, установленных Ветеринарной совместной онкологической группой VCOG [23] и классифицирующихся как полный ответ (CR), частичный ответ (PR), стабильное заболевание (SD) или прогрессирующее заболевание (PD). Измерения исходного уровня опухоли были получены в день 0 с использованием цифрового штангенциркуля и изображения компьютерной томографии (КТ) (XPRESS/G6 CT Scanner, Toshiba, Токио, Япония). Изменения показателей болезни собаки во время лечение проверяли еженедельно в группе VP или каждые 10 дней в группе IM, основываясь на измерении размеров опухоли с помощью цифрового штангенциркуля. Собак исключали из исследования, если их заболевание прогрессировало на основании измерений цифрового штангенциркуля и они получили альтернативное лечение (данные не представлены).
Частота объективных ответов (ORR) была основной конечной точкой эффективности. ORR определялась как процент поддающихся оценке собак, испытывающих CR или PR как наилучшую реакцию. ORR в измерениях размера опухоли на КТ-изображениях через 8 недель в группе IM и через 12 недель в группе VP сравнивали с базовыми показателями, полученными на день 0 в качестве первичной конечной точки эффективности. Опухоли выделяли с помощью полуавтоматического алгоритма сегментации, настроенном в соответствии с данными рентгенолога, и самый длинный диаметр измерялся по контурам МСТ. При множественных опухолях только опухоль с наибольшим диаметром рассматривалась для оценки ответа. ORR определялась как процент поддающихся оценке собак, которые испытали CR или PR как наилучшую реакцию.
2.6. Оценка нежелательных явлений
Оценка нежелательных явлений основывалась на критериях, установленных Ветеринарной совместной онкологической группой (VCOG-CTCAE) [24]. Собак в группе VP проверяли еженедельно перед введением препарата. Собак в группе IM повторно проверяли с интервалом в 10 дней. Оценивали гематологическую токсичность, функцию почек и печени по данным общего анализа крови, креатинина сыворотки и азота мочевины крови, ферментов печени (АЛП и АСТ) соответственно. Гастроинтестинальную токсичность оценивали по эффектам, о которых сообщили владельцы. Пороговое значение числа нейтрофилов для введения винбластина был установлен на уровне ≥2500/мкл (данные не показаны).
2.7. Статистический анализ
Переменные, подлежащие статистическому анализу, были классифицированы как числовые или категориальные. Числовые данные были выражены как средние значения или медианы, а категориальные данные выражали в частотах и процентах. Числовые переменные сравнивались с помощью теста Манна-Уитни. Категориальные переменные сравнивались между когортами с использованием и точного критерия Фишера. Для сравнения данных общего ответа (т.е. сумма PR и CR) у собак, получавших IM или VP, несущих MCT, и этот тест также использовался для сравнения частоты нежелательных явлений 1-й степени у собак, получавших IM и VP лечение. Все сообщаемые значения p являются двусторонними, и p <0,05 использовалось для определения статистической значимости. Все статистический анализ проводили с использованием программного обеспечения GraphPad Prism.
- Результаты
3.1. Пациенты и характеристики опухоли
Двадцать четыре собаки 10 различных пород (боксер, сибирский хаски, лабрадор, бульдог, бернский зенненхунд, йоркширский терьер, питбуль, золотистый ретривер, ротвейлер, аргентинский дог) и дворняги, в возрасте от 2 до 16 лет (средний возраст 8 лет; 12 самцов и 12 самок).
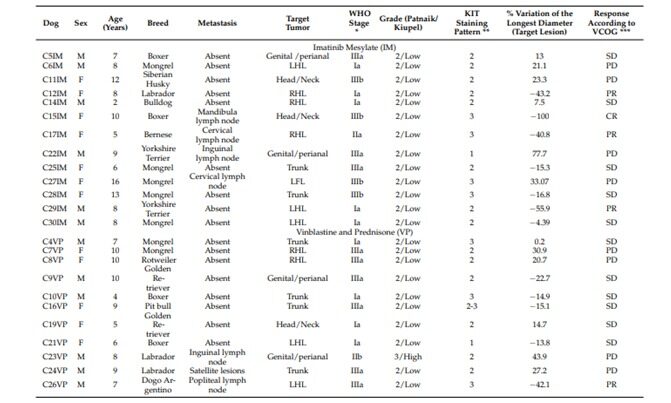
Характеристики собак в группах IM и VP показаны в таблице 2. Все МСТ случаи, включенные в исследование, были кожными. Статистической разницы между породой, полом, возрастом, локализацией, стадией и метастазированием собак, вовлеченных в исследование, не наблюдалось, когда рассматривались две группы лечения (Таблица 3).
Четыре из тринадцати собак из группы IM и две из одиннадцати собак из группы VP имели метастазы в лимфатические узлы на момент постановки диагноза (таблица 3). Только целевые поражения рассматривались для оценки лечения IM или VP.
Таблица 2. Характеристики собак, включенных в исследование, и их реакция на мезилат иматиниба (IM) или винбластин и преднизолон (VP)
Гистологические характеристики образцов MCT от собак, включенных в этот список, представлены в таблице 4. В группе IM 100% случаев были 2-й степени и c низкой оценкой по системам оценок Патнаика и Киупеля соответственно. В группе VP, 90,90% MCT были 2 степени, а 1 MCT — 3 степени; 1 MCT был 3 степени и высокой степени. Классификация опухолей существенно не отличалась между группами (Patnaik и Kiupel классификации: p > 0,999 и p = 0,409).
3.2. KIT Локализация белка
Локализация белка KIT определялась во всех МСТ с помощью микроскопического исследования. Картины окрашивания KIT представлены на рисунке 1 и в таблице 4. Большинство МСТ в группах IM и VP классифицировали по схеме Kit 2 (61,50% и 63,63% соответственно). Характер KIT существенно не отличался между группами (p = 0,999).
3.3. Ответ на лечение
Ответ на лечение оценивали по КТ-изображениям опухолей с использованием одномерного правила (наибольший диаметр) в соответствии с критериями VCOG [23].
Среди 13 собак, несущих MCT, получавших IM, одна достигла CR, трое достигли PR, пять достигли SD и четыре имели PD (7,7%, 23,1%, 38,5% и 30,8% соответственно), что дает общую частоту ответов (сумма CR и PR) 30,76% (таблица 5). Взяв во внимание 11 собак с MCT, получавших VP, ни одна из них не достигла полной ремиссии (CR): у одной собаки была частичный ответ (PR) (9,09%), шесть собак имели стабильную болезнь (SD), и четыре животных имели прогрессирующее заболевание (PD). Данные об ответе на лечение представлены в таблицах 2 и 5.
Таблица 3. Демографические данные животных, включенных в исследование, сравнивающее лечение у собак IM и VP опухолей тучных клеток
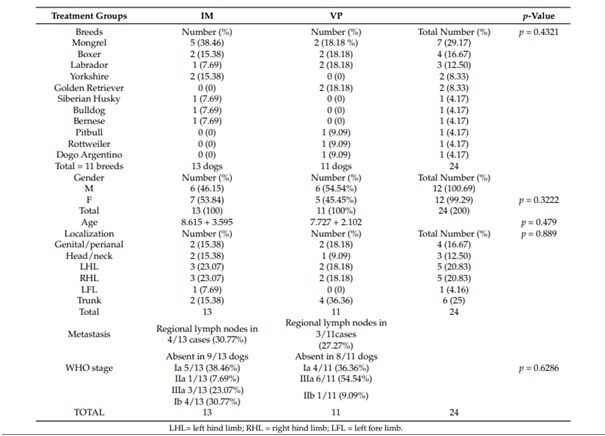
Таблица 4. Гистологические характеристики MCT у собак в двух группах лечения
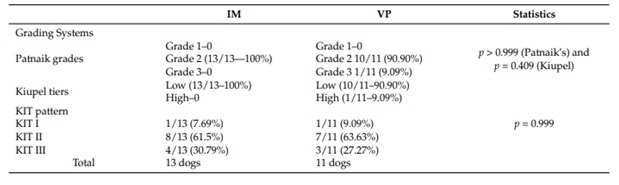
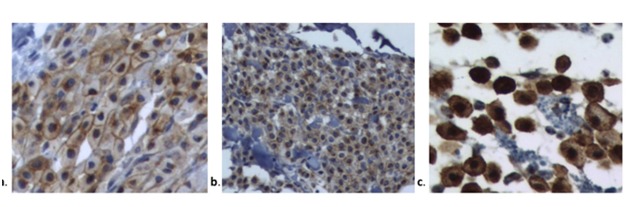
Рис. 1. Окрашивание набора по Kiupel et al., 2004 [19]. (а). Набор I: ассоциированное с мембраной окрашивание, (б). Набор II: цитоплазматическое окрашивание от очагового до пунктирного с уменьшением связанного с мембраной окрашивания (с). Набор III: диффузное цитоплазматическое окрашивание.
Таблица 5. Реакция целевого поражения
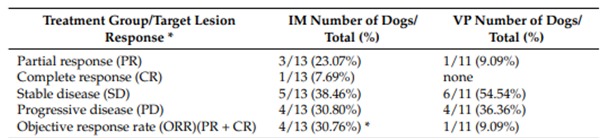
При рассмотрении общего ответа на лечение IM или VP, то есть суммы: полный ответ (CR) + частичный ответ (PR) было проведено сравнение в таблице непредвиденных обстоятельств и проанализировано с помощью точного критерия Фишера, разница была высоко статистически значимой (р = 0,0003). Таким образом, IM определял более высокий общий ответ в этих случаях по сравнению с VP.
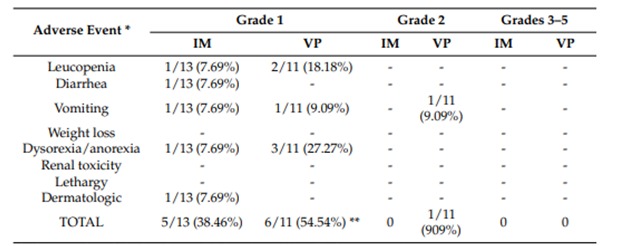
3.4. Неблагоприятные события
Нежелательные явления у пациентов, получавших мезилат иматиниба (IM), винбластин и преднизон (VP) были классифицированы в соответствии с VCOG-CTCAE [24] и приведены в Таблице 6. Нежелательные явления у пациентов, получавших IM, были классифицированы как 1-я степень, в то время как таковые у животных из группы VP относились к 1 и 2 степени; 38,46% собак группы IM и 54,54% в группе VP имели нежелательные явления 1-й степени, а у одной собаки в группе VP — 2-й степени. Когда частоту событий 1 степени у собак с IM сравнивали с таковой у собак с VP, разница была статистически значимой: собаки с VP имели статистически более высокую частоту 1 события.
Таблица 6. Нежелательные явления у пациентов, получавших иматиниба мезилат (IM) или винбластин и преднизолон (VP) согласно VCOG-CTCAE [24]
- Дискуссия
Поскольку тучноклеточные опухоли являются очень распространенными опухолями у собак, приветствуется хорошо переносимое и эффективное лечение. Поэтому исследование таргетной терапии может быть полезно для собак, поскольку эти методы лечения эффективны для людей. VP является стандартным методом химиотерапии после хирургической резекции МСТ собак и препаратами выбора для лечения нерезектабельных опухолей или распространенного заболевания [26,27]. В этом исследовании винбластин вводили в дозах, обычно используемых для лечения МСТ у собак.(2 мг/м2) [28,29]. Насколько нам известно, другой информации в отношении сравнения между IM и VP лечением МСТ собак в литературе нет, что подчеркивает важность этого исследования. Предыдущие исследования показали, что IM может обладать биологической активностью у некоторых собак с MCT [13,30–32]; поэтому мы решили проверить, является ли IM более эффективен для собак, болеющих MCT, чем лечение VP.
Собаки, включенные в это исследование, были получены из Учебной ветеринарной больницы (HOVET) Школы ветеринарной медицины и зоотехники USP. 24 собаки с тучноклеточными опухолями, были разделены на две группы собак в соответствии с заранее определенными критериями включения; таким образом, 13 животных лечили по IM протоколу и 11 животных получали стандартное лечение с помощью VP. Две группы собак показали сопоставимые породы, пол, возраст, локализацию опухолей и стадии болезни, было выявлено отсутствие статистической значимости в сравнениях. Все образцы МСТ были подвергнуты гистопатологическому анализу для подтверждения диагноза и присвоения баллов в соответствии с двумя доступными системами (Патнаика и Киупеля). Кроме того, все МСТ были подвергнуты иммуногистохимическому анализу на c-KIT для оценки их паттернов KIT. И снова МТС случаи, включенные в это исследование, имели схожие степени и образцы окрашивания KIT. Путем статистических сравнений, можно было убедиться, что собаки с MCT, отнесенные к двум лечебным группам начинали с очень похожих условий. Это очень важно, когда проводится сравнение двух методов лечения.
У собак, получивших протоколы IM или VP, первоначально измеряли их опухоли с помощью цифровых штангенциркулей и/или компьютерной томографии, а затем они были измерены в определенные моменты времени. Обе группы собак оценивали животных с PR, SD и PD по протоколу оценки VCOG [23]; однако только в группе IM одно животное представило полную ремиссию. Затем рассчитывали объективную частоту ответов (ORR) путем суммирования процента собак с полным ответом (CR) и процента собак с частичным ответом (PR) в каждой группе лечения. Интересно, что группа IM показала значительно более высокий ORR, чем группа VP.
Иматиниб (STI-571/Gleevec®) представляет собой 2-фениламинопиримидиновое соединение и является селективным ингибитором фермента тирозинкиназы Abl и гена BCR-ABL. Этот препарат действует как специфический конкурент клеточного АТФ-рецептора тирозинкиназного домена Abl и предотвращает способность этого белка переносить фосфатные группы АТФ и фосфорилированные остатки тирозина, препятствующие передаче энергетических сигналов, необходимых для клеток пролиферации и апоптоза. IM был одобрен FDA в 2002 году для лечения неоперабельных и/или метастатических злокачественных стромальных опухолей желудочно-кишечного тракта (GIST) и хронического миелоидного лейкоза (ХМЛ) у человека [33].
В 2003 в Лондоне описали внутренние тандемные дупликации в экзонах 11 и 12 c-kit в опухолях тучных клеток собак [34]. Первое применение мезилата иматиниба в ветеринарной медицине сообщили в 2006 [35], когда идентифицировали c-kit внутреннюю тандемную дупликацию в экзоне 8 тучноклеточной опухоли кошек.
В 2007 [36], впервые показали, что IM эффективен против тучных клеток собак опухоли в моделях ксенотрансплантатов мышей и заявили, что МСТ собак могут быть потенциальной мишенью для терапии иматинибом. Кроме того, IM показал клиническую активность против MCT у 21 собаки, но ответ нельзя было предсказать на основании наличия или отсутствия мутации в экзоне 11 c-kit [13]. IM также вызвала клинический ответ в случае MCT у собак посредством ингибирования конститутивно активированного KIT, вызванного мутацией c-kit c.1523A > T [31]. IM также индуцировал каспаза-зависимый апоптоз в опухолевых тучных клетках собак, обладающих мутациями в экзоне 11 c-kit [37] и продемонстрировал эффективный ответ у двух собак, несущих c-kit мутации в экзоне 11 [32]. IM успешно применяли для лечения собак с стромальными опухолями в желудочно-кишечном тракте с мутацией kit [38].
В нашем исследовании у большинства опухолей тучных клеток была извлечена ДНК и амплифицирована с помощью ПЦР для экзонов 10 и 11; мутации были обнаружены у четырех пациентов (двое из IM и два из группы VP), характеризующиеся заменами оснований вблизи 30 соединение сайт экзона 11, позиция 1759 в кодоне 576 (данные не показаны). Мутации, активирующие внутреннюю тандемную дупликацию, в этом исследовании не обнаружены. Мутации не связаны с реакцией на лечение. Это согласуется с предыдущими исследованиями IM [13].
Нежелательные явления в двух группах собак, несущих МСТ, оценивали и регистрировали. Большинство собак в обеих группах имели нежелательные явления 1-й степени согласно VCOG-CTCAE [24] и только у одного животного из группы VP было нежелательное явление 2 степени. Когда процент собак, у которых наблюдались события 1 степени, сравнивали в обеих группах, процент собак в группе VP был достоверно выше. Побочные эффекты VP в используемых дозах в этом исследовании были сочтены легкими и приемлемыми, отражая в первую очередь гематологическую и желудочно-кишечную токсичность, как сообщалось в ранее [27-29]. Собаки, получавшие IM в этом исследовании имели различную степень желудочно-кишечной токсичности и легкую гематологическую токсичность. Эти побочные эффекты были ниже, чем вызванные химиотерапией VP. Как правило, IM легкая (1-я степень) до умеренной (2-я степень) по интенсивности, проходящая и контролируемая с медицинской точки зрения [31], что говорит о том, что это более безопасная альтернатива лечения МСТ собак. Лечение VP в целом хорошо переносится, но интенсивность дозы должна быть хорошо подобрана для лечения МСТ у собак во избежание неоправданной токсичности [26]. Как и ожидалось, таргетная терапия IM показала менее тяжелые нежелательные явления.
Относительно небольшое количество собак, включенных в исследование, можно считать ограничением. Однако однородные группы собак, получавших IM или VP, в которых не было статистические различия по породам, полу, возрасту, стадиям или классификациям и образцам KIT, может свести к минимуму это ограничение и создать уверенность в статистических различиях между лечением и нежелательными явлениями.
Другое ограничение касается продолжительности лечения в группах IM и VP. Несмотря на то, что собак лечили IM в течение 8 недель, протокол VP имеет продолжительность 12 недель. Даже с учетом этих различий в продолжительности лечения лечение IM было более успешным в течение 8 недель в отношении результата, чем у животных VP, которые заняли 12 недель, и у животных IM было лучше ОRR. Это может представлять собой дополнительное преимущество использования IM.
Мы не включили KIT-секвенирование MCT в этот отчет, хотя это было выполнено в большинстве исследований. Несмотря на то, что что ряд мутаций KIT был обнаружен в собачьих MCT, подход к секвенированию KIT еще не принят в рутинную ветеринарную онкологию, и имеются противоречивые данные, которые недавно были представлены, показывая, что мутации KIT не коррелируют с ответом к ингибиторам тирозинкиназы или даже может иметь худший исход по сравнению с собаками с KIT MCT дикого типа. Поскольку результаты секвенирования экзонов 10 и 11 доступны только в нашем исследовании (данные не показаны), это ограничение, которого мы, несомненно, избежим в группах в будущих исследованиях с участием собачьих MCT.
- Выводы
В заключение, цель этого исследования состояла в том, чтобы сравнить стандартную полихимиотерапию VP и таргетную терапию IM в случаях опухолей тучных клеток, а также для изучения ассоциаций между реакцией на лечение и факторами, которые, как известно, влияют на прогрессирование MCT, такие как гистологическая степень и образец KIT. Хотя другие ингибиторы тирозинкиназы в настоящее время доступны для лечения MCT, включая тоцераниб (Palladia®) и маситиниб (Masivet®), IM — это современная терапия, используемая у людей с опухолями, которую также можно использовать для лечения собаки с MCT. Целью любого клинического исследования в области ветеринарной онкологии является поиск лучшего метода лечения текущих заболеваний, которые сосредоточены на эффективности и безопасности. Наше исследование показало, что IM имеет некоторые преимущества по сравнению с традиционной химиотерапией и может быть использован для пользы и комфорта собак с низкой степенью MCT.
Вклад авторов: исследование и подготовка письма к оригинальному проекту, T.R.M.; методология, T.R.M., T.A.C.C., P.A.A., P.E.B., H.F., S.R.M., M.L.Z.D. и A.C.B.C.F.P., J.M.M.; просмотр и редактирование, G.F.d.Q., M.L.Z.D., J.M.M.; визуализация, надзор и получение финансирования, J.M.M. Все авторы прочитали и согласились с опубликованной версией рукописи.
Финансирование: эта работа была поддержана грантами от FAPESP — Fundação de Amparo a Pesquisa do. Estado de São Paulo (номер гранта 2010/15093-6), за что авторы искренне благодарны.
Заявление Институционального наблюдательного совета: Это исследование было одобрено Комитетом по этике на Использование животных (CEUA) Школы ветеринарной медицины и зоотехники Университета Сан-Паулу, FMVZ—USP (номер процесса 2092/2010).
Заявление об информированном согласии: все владельцы собак, включенных в это исследование, подписали формы согласия.
Заявление о доступности данных: данные предоставляются по запросу.
Благодарности: Это исследование является частью докторской диссертации, представленной Таис Родригес Маседо. в аспирантуру Ветеринарно-хирургической клиники Школы ветеринарной медицины и Животноводство Университета Сан-Паулу, Сан-Паулу, СП, Бразилия, под руководством Джулия Мария Матера.
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Использованные источники:
- Macy, D.W. Canine mast cell tumors. Vet. Clin. N. Am. Small Anim. Pract. 1985, 15, 783–803. [CrossRef]
- Kiupel, M.; Camus, M. Diagnosis and prognosis of canine cutaneous mast cell tumors. Vet. Clin. N. Am. Small Anim. Pract. 2019, 49, 819–836. [CrossRef] [PubMed]
- Willmann, M.; Hadzijusufovic, E.; Hermine, O.; Dacasto, M.; Marconato, L.; Bauer, K.; Peter, B.; Gamperl, S.; Eisenwort, G.; Jensen-Jarolim, E.; et al. Comparative oncology: The paradigmatic example of canine and human mast cell neoplasms. Vet. Comp. Oncol. 2019, 17, 1–10. [CrossRef] [PubMed]
- Preziosi, R.; Morini, M.; Sarli, G. Expression of the KIT protein (CD117) in primary cutaneous mast cell tumors of the dog. J. Vet. Diagn. Investig. 2004, 16, 554–561. [CrossRef]
- Zemke, D.; Yamini, B.; Yuzbasiyan-Gurkan, V. Mutations in the juxtamembrane domain of c-KIT are associated with higher grade mast cell tumors in dogs. Vet. Pathol. 2002, 39, 529–535. [CrossRef] Cells 2022, 11, 571 11 of 12
- Blackwood, L.; Murphy, S.; Buracco, P.; De Vos, J.P.; De Fornel-Thibaud, P.; Hirschberger, J.; Kessler, M.; Pastor, J.; Ponce, F.; Savary-Bataille, K.; et al. European consensus document on mast cell tumours in dogs and cats. Vet. Comp. Oncol. 2012, 10, e1–e29. [CrossRef]
- Patnaik, A.K.; Ehler, W.J.; MacEwen, E.G. Canine cutaneous mast cell tumor: Morphologic grading and survival time in 83 dogs. Vet. Pathol. 1984, 21, 469–474. [CrossRef]
- Kiupel, M.; Webster, J.D.; Bailey, K.L.; Best, S.; DeLay, J.; Detrisac, C.J.; Fitzgerald, S.D.; Gamble, D.; Ginn, P.E.; Goldschmidt, M.H.; et al. Proposal of a 2-tier histologic grading system for canine cutaneous mast cell tumors to more accurately predict biological behavior. Vet. Pathol. 2011, 48, 147–155. [CrossRef]
- Sledge, D.G.; Webster, J.; Kiupel, M. Canine cutaneous mast cell tumors: A combined clinical and pathologic approach to diagnosis, prognosis, and treatment selection. Vet. J. 2016, 215, 43–54. [CrossRef]
- Webster, J.D.; Yuzbasiyan-Gurkan, V.; Kaneene, J.B.; Miller, R.; Resau, J.H.; Kiupel, M. The role of c-KIT in tumorigenesis: Evaluation in canine cutaneous mast cell tumors. Neoplasia 2006, 8, 104–111. [CrossRef]
- London, C.C.; Thamm, D.H. Mast Cell Tumors. In Small Animal Clinical Oncology, 5th ed.; Withrow, S.J., Vail, D.M., Page, R.L., Eds.; Elsevier: St. Louis, MO, USA, 2013; p. 342.
- Dubreuil, P.; Letard, S.; Ciufolini, M.; Gros, L.; Martine, H.; Casteran, N.; Borge, L.; Hajem, B.; Lermet, A.; Sippl, W.; et al. Masitinib (AB1010), a potent and selective tyrosine kinase inhibitor targeting KIT. PLoS ONE 2009, 4, e7258. [CrossRef] [PubMed]
- Isotani, M.; Ishida, N.; Tominaga, M.; Tamura, K.; Yagihara, H.; Ochi, S.; Kato, R.; Kobayashi, T.; Fujita, M.; Fujino, Y.; et al. Effect of tyrosine kinase inhibition by imatinib mesylate on mast cell tumors in dogs. J. Vet. Intern. Med. 2008, 22, 985–988. [CrossRef] [PubMed]
- Séguin, B.; Besancon, M.F.; Mccallan, J.L.; Dewe, L.L.; Tenwolde, M.C.; Wong, E.K.; Kent, M.S. Recurrence rate, clinical outcome, and cellular proliferation indices as prognostic indicators after incomplete surgical excision of cutaneous grade II mast cell tumors: 28 dogs (1994–2002). J. Vet. Intern. Med. 2006, 20, 933–940. [PubMed]
- Misdorp, W. Mast cell and canine mast cell tumours: A review. Vet. Q. 2004, 26, 156–169. [CrossRef] [PubMed]
- Grant, I.A.; Rodriguez, C.O.; Kent, M.S.; Sfilgoi, G.; Gordon, I.; Davis, G.; Lord, L.; London, C.A. A phase II clinical trial of vinorelbine in dogs with cutaneous mast cell tumors. J. Vet. Intern. Med. 2008, 22, 388–393. [CrossRef]
- Thamm, D.H.; Turek, M.M.; Vail, D.M. Outcome and prognostic factors following adjuvant prednisone/vinblastine chemotherapy for high-risk canine mast cell tumour: 61 cases. J. Vet. Med. Sci. 2006, 68, 581–587. [CrossRef]
- Gschwind, A.; Fischer, O.M.; Ullrich, A. The discovery of receptor tyrosine kinases: Targets for cancer therapy. Nat. Rev. Cancer 2004, 4, 361–370. [CrossRef]
- London, C.A. Tyrosine kinase inhibitors in veterinary medicine. Top Companion Anim. Med. 2009, 24, 106–112. [CrossRef]
- Thompson, J.J.; Morrison, J.A.; Pearl, D.L.; Boston, S.E.; Wood, G.A.; Foster, R.A.; Coomber, B.L. Receptor tyrosine kinase expression profiles in canine cutaneous and subcutaneous mast cell tumors. Vet. Pathol. 2016, 53, 545–558. [CrossRef]
- Costa Casagrande, T.A.; de Oliveira Barros, L.M.; Fukumasu, H.; Cogliati, B.; Chaible, L.M.; Dagli, M.L.; Matera, J.M. The value of molecular expression of KIT and KIT ligand analysed using real-time polymerase chain reaction and immunohistochemistry as a prognostic indicator for canine cutaneous mast cell tumours. Vet. Comp. Oncol. 2015, 13, 1–10. [CrossRef] 22. Kiupel, M.; Webster, J.D.; Kaneene, J.B.; Miller, R.; Yuzbasiyan-Gurkan, V. The use of KIT and tryptase expression patterns as prognostic tools for canine cutaneous mast cell tumors. Vet. Pathol. 2004, 41, 371–377. [CrossRef] [PubMed]
- Nguyen, S.M.; Thamm, D.H.; Vail, D.M.; London, C.A. Response evaluation criteria for solid tumours in dogs (v1.0): A Veterinary Cooperative Oncology Group (VCOG) consensus document. Vet. Comp. Oncol. 2015, 13, 176–183. [CrossRef] [PubMed]
- Veterinary cooperative oncology group-common terminology criteria for adverse events (VCOG-CTCAE) following chemotherapy or biological antineoplastic therapy in dogs and cats v1.1. Vet. Comp. Oncol. 2016, 14, 417–446. [CrossRef]
- Owen, L.N.; World Health Organization; Veterinary Public Health Unit & WHO Collaborating Center for Comparative Oncology. TNM Classification of Tumours in Domestic Animals; Owen, L.N., Ed.; World Health Organization: Geneva, Switzerland, 1980.
- Serra Varela, J.C.; Pecceu, E.; Handel, I.; Lawrence, J. Tolerability of a rapid-escalation vinblastine-prednisolone protocol in dogs with mast cell tumours. Vet. Med. Sci. 2016, 2, 266–280. [CrossRef] [PubMed]
- Rassnick, K.M.; Bailey, D.B.; Flory, A.B.; Balkman, C.E.; Kiselow, M.A.; Intile, J.L.; Autio, K. Efficacy of vinblastine for treatment of canine mast cell tumors. J. Vet. Intern. Med. 2008, 22, 1390–1396. [CrossRef]
- Davies, D.R.; Wyatt, K.M.; Jardine, J.E.; Robertson, I.D.; Irwin, P.J. Vinblastine and prednisolone as adjunctive therapy for canine cutaneous mast cell tumors. J. Am. Anim. Hosp. Assoc. 2004, 40, 124–130. [CrossRef]
- Thamm, D.H.; Mauldin, E.A.; Vail, D.M. Prednisone and vinblastine chemotherapy for canine mast cell tumor-41 cases (1992–1997). J. Vet. Intern. Med. 1999, 13, 491–497.
- Webster, J.D.; Yuzbasiyan-Gurkan, V.; Kaneene, J.B.; Miller, R.; Resau, J.H.; Kiupel, M. Evaluation of prognostic markers for canine mast cell tumors treated with vinblastine and prednisone. BMC Vet. Res. 2008, 4, 32. [CrossRef]
- Yamada, O.; Kobayashi, M.; Sugisaki, O.; Ishii, N.; Ito, K.; Kuroki, S.; Sasaki, Y.; Isotani, M.; Ono, K.; Washizu, T.; et al. Imatinib elicited a favorable response in a dog with a mast cell tumor carrying a c-kit c.1523A>T mutation via suppression of constitutive KIT activation. Vet. Immunol. Immunopathol. 2011, 142, 101–106. [CrossRef]
- Nakano, Y.; Kobayashi, T.; Oshima, F.; Fukazawa, E.; Yamagami, T.; Shiraishi, Y.; Takanosu, M. Imatinib responsiveness in canine mast cell tumors carrying novel mutations of c-KIT exon 11. J. Vet. Med. Sci. 2014, 76, 545–548. [CrossRef]
- Radford, I.R. Imatinib. Novartis. Curr. Opin. Investig. Drugs 2002, 3, 492–499. [PubMed] Cells 2022, 11, 571 12 of 12
- Downing, S.; Chien, M.B.; Kass, P.H.; Moore, P.E.; London, C.A. Prevalence and importance of internal tandem duplications in exons 11 and 12 of c-kit in mast cell tumors of dogs. Am. J. Vet. Res. 2002, 63, 1718–1723. [CrossRef] [PubMed]
- Isotani, M.; Tamura, K.; Yagihara, H.; Hikosaka, M.; Ono, K.; Washizu, T.; Bonkobara, M. Identification of a c-kit exon 8 internal tandem duplication in a feline mast cell tumor case and its favorable response to the tyrosine kinase inhibitor imatinib mesylate. Vet. Immunol. Immunopathol. 2006, 114, 168–172. [CrossRef] [PubMed]
- Kobie, K.; Kawabata, M.; Hioki, K.; Tanaka, A.; Matsuda, H.; Mori, T.; Maruo, K. The tyrosine kinase inhibitor imatinib [STI571] induces regression of xenografted canine mast cell tumors in SCID mice. Res. Vet. Sci. 2007, 82, 239–241. [CrossRef] [PubMed]
- Rossi, G.; Bertani, C.; Mari, S.; Marini, C.; Renzoni, G.; Ogilvie, G.; Magi, G.E. Ex vivo evaluation of imatinib mesylate for induction of cell death on canine neoplastic mast cells with mutations in c-Kit exon 11 via apoptosis. Vet. Res. Commun. 2013, 37, 101–108. [CrossRef]
- Irie, M.; Takeuchi, Y.; Ohtake, Y.; Suzuki, H.; Nagata, N.; Miyoshi, T.; Kagawa, Y.; Yamagami, T. Imatinib mesylate treatment in a dog with gastrointestinal stromal tumors with a c-kit mutation. J. Vet. Med. Sci. 2015, 77, 1535–1539. [CrossRef]
- Weishaar, K.M.; Ehrhart, E.J.; Avery, A.C.; Charles, J.B.; Elmslie, R.E.; Vail, D.M.; London, C.A.; Clifford, C.A.; Eickhoff, J.C.; Thamm, D.H. c-Kit Mutation and Localization Status as Response Predictors in Mast Cell Tumors in Dogs Treated with Prednisone and Toceranib or Vinblastine. J. Vet. Intern. Med. 2018, 32, 394–405. [CrossRef]
- Willmann, M.; Yuzbasiyan-Gurkan, V.; Marconato, L.; Dacasto, M.; Hadzijusufovic, E.; Hermine, O.; Sadovnik, I.; Gamperl, S.; Schneeweiss-Gleixner, M.; Gleixner, K.V.; et al. Proposed Diagnostic Criteria and Classification of Canine Mast Cell Neoplasms: A Consensus Proposal. Front. Vet. Sci. 2021, 10, 755258. [CrossRef]